
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фолиевая кислота
|
|
|
|
Фолиевая (птероилглутаминовая) кислота (фолацин) в зависимости от вида животных или штамма бактерий, нуждающихся для нормального роста в присутствии этого пищевого фактора, называлась по-разному: фактор роста L. casei; витамин М, необходимый для нормального кроветворения у обезьян; витамин Вс, фактор роста цыплят (индекс «с» от англ. chicken – цыпленок). В 1941 г. фолиевая кислота была выделена из зеленых листьев растений, в связи с чем и получила свое окончательное название (от лат. folium – лист). Еще до установления химического строения фолиевой кислоты было показано, что для роста некоторых бактерий необходимо присутствие в питательной среде парааминобензойной кислоты. Добавление структурных аналогов ее, в частности сульфаниламидных препаратов, наоборот, оказывало тормозящее действие на рост бактерий. В настоящее время установлено, что это ростстимулирующее действие парааминобензойной кислоты обусловлено включением ее в состав более сложно построенной молекулы фолиевой кислоты.
Фолиевая кислота состоит из трех структурных единиц: остатка 2-амино-4-окси-6-метилптеридина (I), парааминобензойной (II) и L-глутаминовой (III) кислот и имеет следующую структуру:
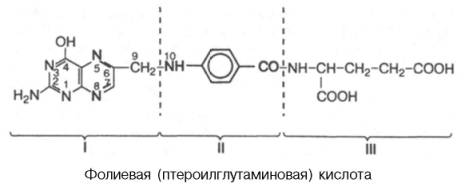
Фолиевая кислота ограниченно растворима в воде, но хорошо растворима в разбавленных растворах спирта. Недостаточность фолиевой кислоты трудно вызвать даже у животных без предварительного подавления в кишечнике роста микроорганизмов, которые синтезируют ее в необходимых количествах; авитаминоз обычно вызывают введением антибиотиков и скармливанием животным пищи, лишенной фолиевой кислоты. У обязьян фолиевая недостаточность сопровождается развитием специфической анемии; у крыс сначала развивается лейкопения, а затем анемия. У человека наблюдается клиническая картина макроцитарной анемии, очень похожая на проявления пернициозной анемии – следствия недостаточности витамина В12, хотя нарушения нервной системы отсутствуют. Иногда отмечается диарея. Имеются доказательства, что при недостаточности фолиевой кислоты нарушается процесс биосинтеза ДНК в клетках костного мозга, в которых в норме осуществляется эритропоэз. Как следствие этого в периферической крови появляются молодые клетки – мегалобласты – с относительно меньшим содержанием ДНК.
Биологическая роль. Коферментные функции фолиевой кислоты связаны не со свободной формой витамина, а с восстановленным его птеридиновым производным. Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии в животных тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолатредуктазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК:
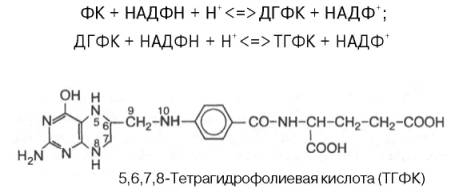
Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина, углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродный атом имидазольного кольца гистидина, а также формальдегид, муравьиная кислота и метанол. К настоящему времени открыто шесть одноуглеродных групп, включающихся в разнообразные биохимические превращения в составе ТГФК: формильная (—СНО), метильная (—СН3), метиленовая (—СН2—), метенильная (—СН=), оксиметильная (—СН2ОН) и формиминовая (—CH=NH). Выяснено, что присоединение этих фрагментов к ТГФК является ферментативной реакцией ковалентного связывания их с 5-м или 10-м атомом азота (или с обоими атомами вместе). В качестве примера приводим отдельные функциональные группы в активных участках ТГФК:
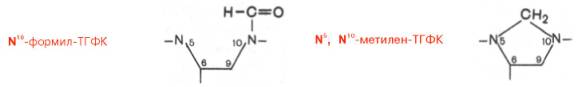
Имеются данные, что производные ТГФК участвуют в переносе одно-углеродных фрагментов при биосинтезе метионина и тимина (перенос метильной группы), серина (перенос оксиметильной группы), образовании пуриновых нуклеотидов (перенос формильной группы) и т.д. Перечисленные вещества играют исключительно важную, ключевую, роль в биосинтезе белков и нуклеиновых кислот, поэтому становятся понятными те глубокие нарушения обмена, которые наблюдаются при недостаточности фолиевой кислоты.
В медицинской практике (в частности, в онкологии) нашли применение некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так, 4-аминоптерин используется в качестве препарата, тормозящего синтез нуклеиновых кислот, и рекомендуется в качестве лечебного препарата при опухолевых поражениях, в частности при острых и хронических формах лейкозов у детей и взрослых.
Распространение в природе и суточная потребность. Вещества, обладающие активностью фолиевой кислоты, широко распространены в природе. Богатыми источниками их являются зеленые листья растений и дрожжи. Эти вещества содержатся также в печени, почках, мясе и других продуктах. Многие микроорганизмы кишечника животных и человека синтезируют фолиевую кислоту в количествах, достаточных для удовлетворения потребностей организма в этом витамине. Суточная потребность в свободной фолиевой кислоте для взрослого человека составляет 1-2 мг.
9.3.7 Витамин В12
Витамин В12 (кобаламин; антианемический витамин) выделен из печени в кристаллическом виде в 1948 г. Задолго до этого было известно, что в печени животных содержится особое вещество, регулирующее процесс кроветворения и оказывающее лечебный эффект при пернициозной (злокачественной) анемии у людей. Однако только в 1955 г. Д. Ходжкин расшифровала его структуру, включая трехмерную пространственную конфигурацию, главным образом при помощи физических методов исследования (рентгенографическая кристаллография). На основании этих данных, а также результатов изучения химического состава для витамина В12 было предложено следующее строение:

В молекуле витамина В12 центральный атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образующих порфириноподобное корриновое ядро, и с атомом азота 5,6-диметил-бензимидазола. Кобальтсодержащая часть молекулы витамина представляет собой планарную (плоскостную) фигуру; по отношению к ней перпендикулярно расположен нуклеотидный лиганд, который, помимо 5,6-диметилбензимидазола, содержит рибозу и остаток фосфата у 3-го атома углерода. Вся структура получила название «кобаламин». Были получены производные витамина В12, содержащие ОН-группу (оксикобаламин), хлор (хлоркобаламин), Н2О (аквакобаламин) и азотистую кислоту (нитритокобаламин). Из природных источников были выделены, кроме того, аналоги В12, которые вместо 5,6-диметилбензимидазола содержали 5-окси-бензимидазол, или аденин, 2-метиладенин, гипоксантин и метилгипоксантин. Все они обладали меньшей биологической активностью, чем кобаламин. Обычно витамин В12 выделяют из микробной массы или животных тканей, используя растворы, содержащие ионы цианида. Однако цианокобаламин метаболически неактивен. В состав В12-коферментов вместо CN входит остаток 5-дезоксиаденозина или метильная группа.
У человека и животных недостаток витамина В12 приводит к развитию злокачественной макроцитарной, мегалобластической анемии. Помимо изменений кроветворной функции, для авитаминоза В12 специфичны также нарушения деятельности нервной системы и резкое снижение кислотности желудочного сока. Оказалось, что для активного процесса всасывания витамина В12 в тонкой кишке обязательным условием является наличие в желудочном соке особого белка – гастромукопротеина, получившего название внутреннего фактора Касла, который специфически связывает витамин В12 в особый сложный комплекс. Точная роль этого фактора во всасывании В12 не выяснена. Предполагают, что в связанном с этим фактором комплексе витамин В12 поступает в клетки слизистой оболочки подвздошной кишки, затем медленно переходит в кровь портальной системы, а внутренний фактор подвергается гидролизу (распаду). Следует указать, что В12 поступает в кровь портальной системы не в свободном состоянии, а в комплексе с двумя белками, получившими название транскобаламинов I и II, один из которых выполняет функцию депо В12 (I), поскольку он более прочно связывается с витамином В12. Поэтому нарушение синтеза внутреннего фактора в слизистой оболочке желудка приводит к развитию авитаминоза В12 даже при наличии в пище достаточного количества кобаламина. В подобных случаях витамин с лечебной целью обычно вводят парентерально или с пищей, но в сочетании с нейтрализованным желудочным соком, в котором содержится внутренний фактор.
Витамин В12 используется в клинике для лечения различных форм анемий с неврологическими нарушениями, которые обычно не поддаются лечению другими витаминами, в частности фолиевой кислотой.
Биологическая роль. Выявлены ферментные системы, в составе которых в качестве простетической группы участвуют не свободный витамин В12, а так называемые В12-коферменты, или кобамидные коферменты. Последние отличаются тем, что содержат 2 типа лигандов: метильную группу и 5'-дезоксиаденозин. Соответственно различают метилкобаламин СН3-В12 и дезоксиаденозилкобаламин. Превращение свободного витамина В12 в В12-коферменты, протекающее в несколько этапов, осуществляется в организме при участии специфических ферментов в присутствии в качестве кофакторов ФАД, восстановленного НАД, АТФ и глутатиона. В частности, при образовании 5-дезоксикобаламинового кофермента АТФ подвергается необычному распаду с отщеплением трифосфатного остатка по аналогии еще с одной единственной реакцией синтеза 5-аденозилметионина из метионина и АТФ (см. главу 12). Впервые В12-коферменты были выделены Г. Баркером и сотр. в 1958 г. из микроорганизмов, позже было доказано их существование в тканях животных.
Химические реакции, в которых витамин В12 принимает участие как кофермент, условно делят на 2 группы в соответствии с его химической природой. К первой группе относятся реакции трансметилирования, в которых метилкобаламин выполняет роль промежуточного переносчика метильной группы (реакции синтеза метионина и ацетата).
Вторая группа реакций при участии В12-коферментов заключается во внутримолекулярном переносе водорода в реакциях изомеризации.
В настоящее время высказывается предположение о более широком участии В12-коферментов в ферментативных реакциях трансметилирования, дезаминирования (например, этаноламиддезаминазная реакция) и др. Предстоит, однако, приложить немало усилий, чтобы выяснить молекулярные механизмы действия витамина В12 на процесс кроветворения. Положительный эффект при лечении пернициозной анемии полусырой печенью обусловлен, как стало известно, наличием витамина В12, хотя следует указать, что большего лечебного эффекта можно добиться при одновременном введении внутреннего фактора слизистой оболочки желудка.
Распространение в природе и суточная потребность. Витамин В12 является единственным витамином, синтез которого осуществляется исключительно микроорганизмами; ни растения, ни ткани животных этой способностью не наделены. Основные источники витамина В12 для человека – мясо, говяжья печень, почки, рыба, молоко, яйца. Главным местом накопления витамина В12 в организме человека является печень, в которой содержится до нескольких миллиграммов витамина. В печень он поступает с животной пищей, в частности с мясом, или синтезируется микрофлорой кишечника при условии доставки с пищей кобальта. Суточная потребность в витамине В12 для взрослого человека составляет около 3 мкг (0,003 мг).
9.3.8 Пантотеновая кислота (витамин В3)
Пантотеновая кислота в качестве витамина была открыта в 1933 г. Р. Уильямсом и соавт. в составе «биоса» – группы веществ природного происхождения, стимулирующих рост дрожжей. Он оказался чрезвычайно широко распространенным во всех живых объектах (микроорганизмы, растения, ткани животных), в связи с чем, было предложено название «пантотеновая кислота» (от греч. pantoten – повсюду). В 1938 г. эти же авторы выделили ее из дрожжей и печени в высокоочищенном состоянии в форме кристаллической кальциевой соли, а в 1940 г. была расшифрована ее структура, подтвержденная химическим синтезом.
Пантотеновая кислота является комплексным соединением β-аланина и 2,4-диокси-3,3-диметилмасляной кислоты.

Пантотеновая кислота представляет собой вязкую светло-желтую жидкость, хорошо растворимую в воде; она малоустойчива и легко гидролизуется по месту пептидной связи под действием слабых кислот и щелочей.
При недостаточности или отсутствии пантотеновой кислоты у человека и животных развиваются дерматиты, поражения слизистых оболочек, дистрофические изменения желез внутренней секреции (в частности, надпочечников) и нервной системы (невриты, параличи), изменения в сердце и почках, депигментация волос, шерсти, прекращение роста, потеря аппетита, истощение, алопеция. Все это многообразие клинических проявлений пантотеновой недостаточности свидетельствует об исключительно важной биологической роли ее в метаболизме.
Биологическая роль. Пантотеновая кислота входит в состав кофермента А, или коэнзима А (КоА). Название «коэнзим А» (кофермент ацилирования) связано с тем, что это соединение участвует в ферментативных реакциях, катализирующих как активирование, так и перенос ацетильного радикала СН3СО; позже оказалось, что КоА активирует и переносит также другие кислотные остатки (ацилы). В результате образования ацил-КоА происходит активация карбоновой кислоты, которая поднимается на более высокий энергетический уровень, создающий выгодные термодинамические предпосылки для ее использования в реакциях, протекающих с потреблением энергии.
Строение КоА расшифровал Ф. Линен. В основе структуры лежит остаток 3'-фосфоаденозин-5'-дифосфата (отличается от АТФ наличием у 3'-гидроксила фосфатной группы), соединенный с остатком пантотеновой кислоты, карбонильная группа которой в свою очередь связана с остатком β-меркаптоэтиламина (тиоэтиламина).
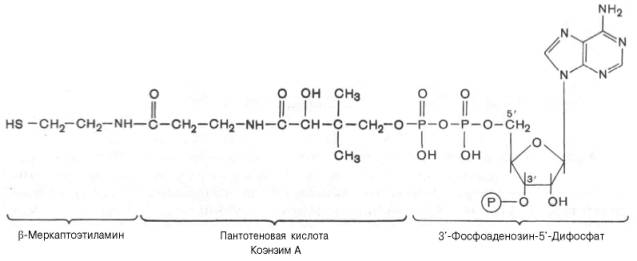
Реакционноспособным участком молекулы КоА в биохимических реакциях является SH-группа, поэтому принято сокращенное обозначение КоА в виде SH-KoA. О важнейшем значении КоА в обмене веществ свидетельствуют обязательное непосредственное участие его в основных биохимических процессах, окисление и биосинтез высших жирных кислот, окислительное декарбоксилирование α-кетокислот (пируват, α-кетоглутарат), биосинтез нейтральных жиров, фосфолипидов, стероидных гормонов, гема гемоглобина, ацетилхолина, гиппуровой кислоты и др.
Распространение в природе и суточная потребность. Уже отмечалось широкое, повсеместное распространение пантотеновой кислоты в природе. Основными пищевыми источниками ее для человека являются печень, яичный желток, дрожжи и зеленые части растений. Пантотеновая кислота синтезируется, кроме того, микрофлорой кишечника. Суточная потребность в пантотеновой кислоте для взрослого человека составляет 3–5 мг.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 1079; Нарушение авторских прав?; Мы поможем в написании вашей работы!