
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа газа при изменении его объема
|
|
|
|
Первое начало термодинамики
Внутренняя энергия макроскопической системы качественно отличается от механической энергии частиц, образующих систему. Это проявляется в существовании двух форм изменения внутренней энергии – работы и теплопередачи (теплообмена). Работа совершается в тех случаях, когда при взаимодействии системы с окружающими телами возникает какое-либо упорядоченное движение. В частности, газ совершает работу только при изменении его объема. В процессе теплопередачи также может происходить изменение внутренней энергии, обусловленное изменением энергии частиц, образующих систему, и не связанное с совершением работы. Изменение внутренней энергии в этом случае измеряется количеством тепла.
Закон сохранения энергии, в котором учитывается особая форма передачи энергии путем теплопередачи, является фундаментальным законом физики и называется первым началом термодинамики: «Количество тепла, полученное системой, расходуется на приращение внутренней энергии системы и на совершение системой работы над внешними телами (системами)».
Первое начало сформулировано на основании обобщения опытных фактов и справедливо для всех тепловых процессов. Последнее соотношение является термодинамическим определением внутренней энергии системы.
«Внутренняя энергия системы является функцией ее состояния, определенной с точностью до произвольной постоянной, приращение которой равно разности между количеством тепла, полученным системой, и работой, совершенной системой в ходе теплового процесса».
Изменение внутренней энергии зависит только от начального и конечного состояний системы. Работа и количество тепла зависят от вида процесса, переводящего систему из начального состояния в конечное, т.е. они не являются функциями состояния системы.
Если система периодически возвращается в первоначальное состояние, то DU=0 и A=Q, т.е. нельзя построить вечный двигатель, который совершал бы большую по величине работу, чем количество сообщенной ему извне энергии.
По форме обмена энергией можно выделить три вида систем:
1) изолированные (dQ=0, dA=0),
2) теплоизолированные (адиабатические) (dQ=0, dA¹0),
3) тепловые резервуары (dA=0, dQ¹0).
Найдем работу, совершаемую газом при изменении его объема. Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде (рис. 17).
 |
Если газ, расширяясь, передвигает поршень на расстояние dx, то он производит работу против сил внешнего давления ре:
 ,
,
где S - площадь поршня, dV - изменение объема газа. Полная работа А12, совершаемая газом при изменении его объема от V1 до V2:
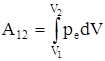 .
.
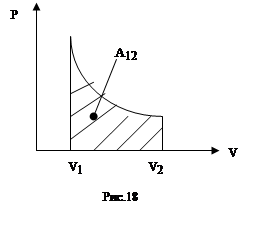
Если процесс расширения газа является равновесным, т.е. идущим без перепадов давлений и температур, то работа может быть вычислена через давление самого газа (ре=р). Графически работа газа равна площади под кривой процесса на диаграмме PV (рис.18). Если газ совершает круговой процесс (цикл), то работа будет равна площади цикла.
Работа газа при изопроцессах:
1) изохорический
V=const, dV=0, A12=0;
2) изотермический T=const,
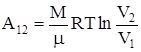 ;
;
3) изобарический р=const,
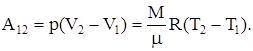
 |
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 2457; Нарушение авторских прав?; Мы поможем в написании вашей работы!