
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гипотеза Авогадро
|
|
|
|
В 1808 г. французский ученый Ж. Л. Гей-Люссак (1778–1850) на основе изучения химических реакций газов открыл еще один фундаментальный закон химии – закон простых объемных отношений.
Гей-Люссак изучал реакции между различными газами, но всегда отношения между объемами реагирующих газов и объемами полученных газообразных продуктов реакции выражались простыми целыми числами. Например, 1 л хлора соединяется с 1 л водорода, образуя 2 л хлорводорода; 2 л водорода соединяются с 1 л кислорода, образуя 2 л водяного пара; при электролитическом разложении воды образуются один объем кислорода и два объема водорода и т.д.
Обобщением этих результатов и явился закон простых объемных отношений, согласно которому объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа (рис4.2).
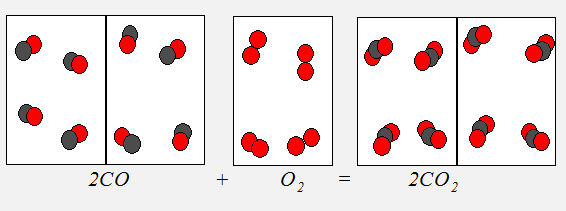
Рис. 4.2. Два объема окиси углерода, соединяясь с одним объемом кислорода, дают два объема углекислого газа.
Открытие закона простых объемных отношений вызвало споры среди ученых, т.к. многие из них приняли атомистическую гипотезу Дальтона и считали, что в равных объемах различных газов содержится одинаковое число атомов, что никак не могло объяснить новый закон. Подлинный смысл закона объемных отношений выяснился после открытия великого итальянского химика А. Авогадро (1776–1856), который в 1811 г. предположил, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Эта гипотеза Авогадро, впоследствии названная законом, основывалась на молекулярных представлениях и означала, что все газы ведут себя в некотором смысле одинаково и что объем газа при заданных условиях не зависит от химической природы газа, а определяется только числом частиц. Измеряя объем, мы можем определить число частиц в газовой фазе. Большая заслуга Авогадро состоит в том, что он смог установить простую связь между наблюдаемой макроскопической величиной (объемом) и микроскопическими свойствами газообразных веществ (числом частиц).
Закон Авогадро ввел в науку представление о молекулах как о мельчайших частицах вещества, причем, представление об атомах как о мельчайших частицах элемента сохранялось. Авогадро особенно подчеркивал, что молекулы простых веществ отнюдь не должны быть тождественны с атомами, а, напротив, они обычно состоят из нескольких атомов данного элемента.
Закон Авогадро позволил сделать вывод о числе атомов в молекулах газов. Анализируя объемные отношения Гей-Люссака, и используя свою гипотезу, Авогадро установил, что молекулы простых веществ (водорода, хлора, кислорода, азота) состоят из двух атомов. Это предположение объяснило закон простых объемных отношений Гей-Люссака. Например, при соединении водорода с хлором их молекулы распадаются на атомы, которые образуют молекулы хлорводорода. Но поскольку из одной молекулы водорода и одной молекулы хлора образуются две молекулы хлорводорода, то его объем должен быть равен сумме объемов исходных газов:
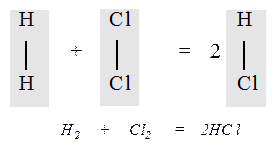
Из закона Авогадро вытекает важное следствие: при одинаковых условиях 1 моль любого газа занимает один и тот же объем, в частности, при нормальных условиях этот объем равен 22,4 л.
Как это ни странно, но современники Авогадро не признали и не оценили его достижений. Ведущие химики того времени Дальтон и Берцелиус возражали против того, что молекулы простых веществ могут быть двухатомны, поскольку полагали, что молекулы образуются только из разных атомов. Под давлением таких авторитетов гипотеза Авогадро была отвергнута и постепенно забыта вплоть до середины девятнадцатого века, когда основные положения атомно-молекулярного учения получили всеобщее понимание и признание.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 2987; Нарушение авторских прав?; Мы поможем в написании вашей работы!