
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы расчета в объемном методе анализа
|
|
|
|
Понятие об эквиваленте. Объемные методы анализа.
1. Задание {{ 71 }} ТЗ № 71
В методах объемного анализа титр раствора рассчитывается по формуле
- T= 
+ T= 
- T=NЭ
- T=mV
2. Задание {{ 72 }} ТЗ № 72
Зная титр раствора нормальную концентрацию раствора можно определить по формуле
- T= 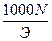
+ N= 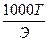
- N= 
- N= 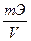
3. Задание {{ 125 }} ТЗ № 125
Для приготовления 1л 0,1н раствора KMnO4 для титрования в кислой среде надо взять навеску соли массой (г)
+ 3,16
- 31,6
- 15,8
- 5,27
4. Задание {{ 126 }} ТЗ № 126
Для приготовления 0,5л 0,01н раствора KMnO4 для перманганатометрии надо взять навеску соли массой (г)
- 0,316
+ 0,158
- 3,16
- 15,8
5. Задание {{ 127 }} ТЗ № 127
Для приготовления 0,5л 0,01н раствора NaOH надо взять навеску массой (г)
- 0,1
+ 0,2
- 0,3
- 0,4
6. Задание {{ 596 }} ТЗ № 596
Если для одного раствора известна нормальная концентрация N1 и объем V1, а для другого только объем V2, то можно определить нормальную концентрацию N2 последнего раствора по формулам:
- 
- 
+ 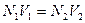
+ 
7. Задание {{ 597 }} ТЗ № 597
Титр 0,1 н HCl равен
- 0,1
- 0,0365
+ 0,00365
- 36,5
8. Задание {{ 598 }} ТЗ № 598
На титрование 20мл раствора HCl израсходовано 19,2 мл 0,1 н NaOH. Нормальная концентрация раствора HCl
- 0,1
+ 0,096
- 0,048
- 0,024
9. Задание {{ 599 }} ТЗ № 599
Нормальная концентрация раствора H2SO4 с титром 0,0196 г/мл равняется
- 2
- 1
- 0,5
+ 0,4
- 0,3
10. Задание {{ 600 }} ТЗ № 600
На титрование 12 мл раствора, содержащего 7,45 г/л KCl потребуется 0,1 н AgNO3 в объеме (мл)
- 6
+ 12
- 24
- 48
11. Задание {{ 601 }} ТЗ № 601
На титрование 25 мл раствора KCl израсходовано 34 мл 0,1 н раствора AgNO3. Масса KCl в 250 мл такого раствора (г)
- 5,066
+ 2,533
- 7,599
- 10,3
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 628; Нарушение авторских прав?; Мы поможем в написании вашей работы!