
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотные оксиды
Основные оксиды
Химические свойства оксидов
К основным оксидам относятся:
– оксиды всех металлов главной подгруппы первой группы (щелочные металлы Li – Fr),
– главной подгруппы второй группы, начиная с магния (Mg – Ra) и
– оксиды переходных металлов в низших степенях окисления, например, MnO, FeO.
1°. Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными, растворимыми в воде основаниями — щелочами, например,
BaO + H2O = Ba(OH)2;
Na2O + H2O = 2 NaOH.
2°. Основные оксиды взаимодействуют с кислотами образуя соли:
CaO + 2 HCl = CaCl2 + H2O.
3°. Также к образованию соли приводит взаимодействие их с кислотными оксидами:
Na2O(тв.) + СO2(газ) = Na2CO3
CaO(тв.) + SO3(ж.) = CaSO4
СaO(тв.) + SiO2(тв.) 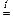 CaSiO3.
CaSiO3.
Большинство оксидов неметаллов являются кислотными оксидами (СО2 , SO3, P4O10 и др.). Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов, например: CrO3, Mn2O7, V2O5.
1°. Кислотные оксиды реагируют с водой с образованием соответствующих кислот:
SO3 + H2O = H2SO4
P4O10 + 6 H2O = 4 H3PO4.
Некоторые оксиды, например, SiO2, MoO3 и др. с водой непосредственно не взаимодействуют и соответствующие им кислоты могут быть получены косвенным путем:
(x – 1) H2O + Na2SiO3 + 2 HCl = 2 NaCl + SiO2 × x H2O ¯
Na2MoO4 + 2 HCl = 2 NaCl + H2MoO4 ¯.
2°. Взаимодействие кислотных оксидов с основными оксидами приводит к образованию солей:
SO2 + Na2O = Na2SO3
SiO2 + CaO 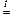 CaSiO3.
CaSiO3.
3°. Также к образованию солей ведет реакция кислотного оксида с основанием.
Cl2O + 2 NaOH = 2 NaClO + H2O.
Если кислотный оксид является ангидридом многоосновной кислоты, то в зависимости от относительных количеств основания и кислотного оксида, участвующих в реакции, возможно образование средних
Ca(OH)2 + CO2 = CaCO3 ¯ + H2O.
или кислых солей
CaCO3 ¯ + H2O + CO2 = Ca(HCO3)2 р-р.
4°. Мало летучие оксиды вытесняют летучие оксиды из солей:
Na2CO3 + SiO2 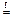 Na2SiO3 + CO2.
Na2SiO3 + CO2.
|
|
Дата добавления: 2014-11-16; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!