
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Раствор Ме
|
|
|
|
ЭТАП 3. Составление оборотной ведомости, бухгалтерского баланса.
Оборотная ведомость – это сводка оборотов и остатков счетов за определенный период. Данные оборотной ведомости берутся непосредственно из счетов. Для этого в счетах подытоживаются обороты и выводятся новые остатки.
После записи счетов проверяют правильность проведения конечных остатков. Затем по всем колонкам оборотной ведомости производится подсчет общих итогов – начальных остатков, оборотов и конечных остатков. Основная особенность оборотной ведомости – три пары равных итогов.
Далее следует составить бухгалтерский баланс на 01.02….года.
Он заполняется на основании оборотной ведомости по синтетическим счетам - необходимо перенести из нее в таблицу баланса конечные остатки счетов дебетовые – в актив, а кредитовые – в пассив (Бухгалтерский баланс можно заполнить в стандартной форме отчетности – ф.№1 «Бухгалтерский баланс», либо представить его в виде таблицы упрощенной формы, которая должна содержать все разделы актива и пассива бухгалтерского баланса и все статьи, имеющие остатки на начало (конец) отчетного периода (остатки на начало берутся из табл. №1).
2) Неактивные М (Cu, Ag) Þ адсорбция ионов из раствора Þ (+ Е);
Мn+ + ne ® Ме
3) Благородные М (Au, Pt) Þ Qсубл и Iиониз высока Þ разность потенциалов не возникает за счет перехода ионов Þ может за счет адсорбции молекул газа Þ газовые электроды.
· Равновесный потенциал, Е р, - потенциал электрода при равновесии (в отсутствие электрического тока – цепь разомкнута)
Е р определяется способностью электрода посылать ионы в раствор (зависит от природы электрода, активности ионов, температуры). Абсолютное значение скачка Δφ в ДЭС измерить нельзя. Измеряют разность потенциалов между двумя электродами: Е =Δφ1–Δφ2.
· Электродный потенциал Е Мn+/М - значение потенциала электрода, измеренное относительно электрода сравнения, потенциал которого принимают равным 0 (разность потенциалов между электродом сравнения и электродом). В водородной шкале потенциалов за нуль - потенциал стандартного водородного электрода.
· Стандартный потенциал, Е 0, - равновесный электродный потенциал, если и металл и раствор находятся в стандартных состояниях (при Р=1 атм и концентрации (активности) ионов 1 моль/л), табличные Е 0 при Т 298К.
В общем случае: ЕOx/Red для потенциалопределяющей реакции Ox+neÛRed, где «Оx» -окисленная, а «Red»- восстановленная формы вещества.
 Водородный электрод: Н+ / Н2(Pt) платинированная Pt (адсорбция Н2)
Водородный электрод: Н+ / Н2(Pt) платинированная Pt (адсорбция Н2)
H2газ
H+ (H2SO4)
раствор
H2газ
Схема водородного электрода
Потенциалопределяющая реакция: 2Н+р + 2е Û(2НадÛ) Н2г на границе М- раствор.
Условно: Е 0Н+/Н2 = 0 В если система в стандартном состоянии - стандартный во дородный электрод
р Н2 = 1 (101кПа); а Н+= 1моль/л и Т = 298 К
Подобно водородному - другие газовые электроды (кислородный, хлорный …)
Таблица стандартных электродных потенциалов – потенциалы в порядке возрастания (по уменьшению восстановительной и повышению окислительной активности систем).
Ряд металлов, расположенных в порядке возрастания их Е 0 – ряд напряжения металлов, определяется только природой (а = 1моль/л, р= 1, Т=298К)
Чем меньше Е 0, тем выше восстановительная способность восстановленной формы (металла) и ниже окислительная способность его ионов.
В ряду напряжений металл способен вытеснять следующие за ним в ряду металлы из растворов их солей.
Cd + NiSO4 Û Ni + CdSО4.
Е 0 - частный случай Е р (определяется только природой электрода)
Гальванический элемент
Гальванический элемент -электрохимическая система, в которой химическая энергия превращается в электрическую
Первичный гальванический элемент Даниэля Якоби -простейший источник тока, в котором протекает электрохимическая реакция (окислительная и восстановительная полуреакции разделены пространственно, а переход электронов происходит по проводникам 1-го рода).
Схема гальванического элемента
 |




При разомкнутой цепи Þ равновесие: Zn2+ + 2e  Zn
Zn
Cu2+ + 2e  Cu
Cu
Е0 Cu2+/Cu = 0,337 B; Е0 Zn2+/Zn = -0,763 B
Е Э = (Е К – Е А) > 0 Þ Е К > Е А ÞCu2+/Cu – Катод, аZn2+/Zn – Анод
Цепь замкнута:
(-) АНОД: Zno → Zn2+ + 2e – окисление
(+) КАТОД: Cu+2 + 2e → Cuo - восстановление
ТОР (токообразующая реакция): Zno + Cu2+ (р) → Zn2+ (р) + Cuo
Е0 Э = Е0 Cu2+/Cu – Е0 Zn2+/Zn = 0,337 – (-0,763) = 1,1 B
Необходимое условие работы любого ГЭ - наличие разности потенциалов. Процессы окисления и восстановления будут идти пока не сравняются потенциалы.
Максимальная разность потенциалов электродов, которая может быть получена при работе ГЭ – электродвижущая сила ГЭ (ЭДС) Еэ = Ек –Еа
С помощью ГЭ можно совершить электрическую работу: -D rG = А полезн max; D G ТОР = А электр
С другой стороны, электрическая работа, совершаемая ГЭ: А электрич = Q . Еэ
Q – кол –во прошедшего электричества.
Максимальная работа ГЭ при превращении 1 моля вещества: А электр max = nFEЭ
ЕЭ – ЭДС;
n– число моль эквивалентов в моле вещества или число электронов, участвующих в ТОР.
После подстановки: D G ТОР = - nFEЭ; D G0ТОР = - nFE0Э - основные уравнения, связывающие химические и электрические характеристики.
Изменение энергии Гиббса зависит от рi или Сi реагентов согласно изотерме Вант Гоффа.
Для ТОР ГЭ а А(р) + b В(т) Û d D(р) + l L(т)) изотерма Вант Гоффа
D G ТОР = D G0 ТОР + RTln  , разделив на «-nF» имеем уравнение Нернста для ЭДС
, разделив на «-nF» имеем уравнение Нернста для ЭДС
 Е Э = -
Е Э = -  , Е Э =
, Е Э = 
Е0Э
Если для создания ГЭ используют одинаковые электроды и один и тот же электролит разной концентрации, то ГЭ работает за счет выравнивания концентраций и называется концентрационным.
Связь ЭДС с константой равновесия ТОР D G0 ТОР = - RTlnKa ≈ - RTlnKс Þ 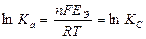
 Согласно уравнению Гиббса-Гемгольца ∆S = nF
Согласно уравнению Гиббса-Гемгольца ∆S = nF  и температурная зависимость ЭДС ГЭ:
и температурная зависимость ЭДС ГЭ:  =
= 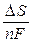 ,
,
где 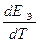 - температурный коэффициент ЭДС
- температурный коэффициент ЭДС
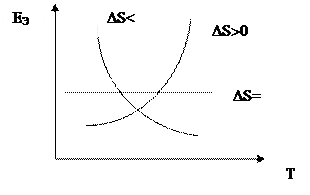
 Температурная зависимость ЭДС гальванического элемента
Температурная зависимость ЭДС гальванического элемента
Вывод: измеряя ЕЭ и 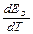 определяют DG, DН и DS – реакции, протекающей в ГЭ. ЭДС измеряют либо высокоомным вольтметром, либо компенсационным методом.
определяют DG, DН и DS – реакции, протекающей в ГЭ. ЭДС измеряют либо высокоомным вольтметром, либо компенсационным методом.
Преимущества ХИТ: автономность, бесшумность,относительная безвредность и относительно высокий КПД.
Потенциалы металлических электродов
Для определения потенциалов металлических электродов по водородной шкале собирают ГЭ, одним из электродов которого является измеряемый, а другим – стандартный водородный. ЭДС такого ГЭ равна измеряемому потенциалу (по абсолютной величине).
Схемы измерения:

стандартная ЭДС ГЭ: 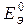

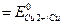 =+0,337
=+0,337

стандартная ЭДС ГЭ: 

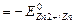 = 0,763 В Þ
= 0,763 В Þ  = -0,763 В.
= -0,763 В.
Стандартная ЭДС Zn/Cu ГЭ: Е0Э = Е0Cu2+/Cu - Е0Zn2+/zn = 0,337 – (-0,763) =1,1В
ЭДС – максимально возможная разность потенциалов между катодом и анодом всегда положительная:
D G0ТОР = - nFE0Э.
Общий случай:
пусть при измерении потенциала по водородной шкале: ТОР Mn+ + n/2H2 = M + nH+
измеренная ЭДС: Еэ = Ек – Еа = Е Mn+/ M,
подставляя в уравнение связи химической и электрической форм энергий D G0ТОР = - nFE0Э (4), получаем уравнение Нернста для металлических электродов
( потенциалопределяющая реакция: M(р-р)n+ + n e Û M(к)) 
Для Т = 298 К 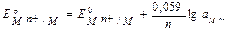 - зависимость потенциала от природы, активности, температуры.
- зависимость потенциала от природы, активности, температуры.
R – универсальная газовая постоянная, 8,31Дж/(моль.К);
n – число электронов, принимающих участие в реакции
F – число Фарадея, 96500 Кл/моль (26,8 А.час/моль);
T – температура, К.
Уравнение Нернста для Ox /Red систем: в общем случае для потенциалопределяющей реакции:
Ox + n e Û Red. 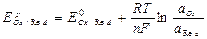
Уравнение Нернста для водородного электрода: потенциалопределяющая реакция 2Н+ + 2е  Н2
Н2  ,
,
Е0Н /H2=0 В, рН = -lgaH+, Т = 298 К 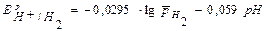
Если  Þ
Þ 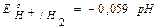
Уравнение Нернста для кислородного электрода: потенциалопределяющая реакция О2+4  +2Н2О
+2Н2О  4ОН–
4ОН– 
Е0О2/ОН- = 0,401 В, Т = 298 К рН = 14 – рОН = 14 + lga ОН-
Если 
 Þ
Þ 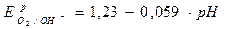
Существует диаграмма устойчивости воды, отражающая зависимость потенциала от рН
Задача1.
Напишите катодные и анодные процессы цинк-серебрянного ГЭ, рассчитайте Е0Э при Т = 298 К и ЕЭ при aктивностях ионов Zn2+ и Ag+ равных по 0,01 моль/л.
Решение.
 Из таблицы:
Из таблицы: 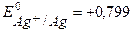 В,
В,  В. Т.к.
В. Т.к.  Þ Ag+/Ag – катод, Zn2+/Zn – анод.
Þ Ag+/Ag – катод, Zn2+/Zn – анод.
 А: Zn ® Zn+2 + 2e 2 1
А: Zn ® Zn+2 + 2e 2 1
K: Ag+ + e ® Ag 2
ТОР: Zn +2Ag+ ® Zn+2 + 2Ag
Е0Э = Е0К – Е0А = Е0Ag+/Ag – E0Zn2+/Zn = 0,799 – (– 0,763) = 1,562 В
∆G0ТОР = ∆fG0 Zn2+ + 2∆fG0Ag – (∆fG0 Zn + 2∆fG0Ag+) = 147160 + 2.0 – (0 + 2.77100) = -301360 Дж
 B.
B.
Уравнение Нернста для металлических электродов (а Zn2+ = а Ag+ = 0,01 моль/л):
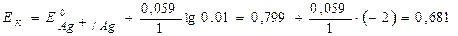 B.
B.
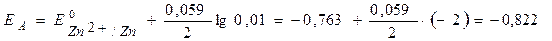 B.
B.
ЕЭ = ЕК – ЕА = ЕAg+/Ag – EZn2+/Zn = 0,681– (– 0,822) = 1,503 В
ЕЭ0 > ЕЭ
Задача 2.
Рассчитайте ЭДС концентрационного ГЭ: H2,Pt|НCl||СН3СООН|H2,Pt, работающего при одинаковых давлениях  и одинаковых концентрациях водных растворов кислот С0 = 0,1 моль/л.
и одинаковых концентрациях водных растворов кислот С0 = 0,1 моль/л.
Решение.
Для кислой среды уравнения электродных реакций в концентрационном элементе:
А -: H2 → 2H+ + 2 
К+: 2H+ + 2  → H2
→ H2
Величина равновесного потенциала этих электродов определяется по уравнению
 , при
, при  .
.
Активность ионов водорода  :
:
а) в растворе уксусной кислоты: СН3СООН  СН3СООН– + H+,
СН3СООН– + H+,
т.к. уксусная кислота является слабым электролитом, то коэффициент активности  и
и 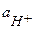 ≈
≈ 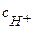 ; константа диссоциации Кд = 1,75 10-5,
; константа диссоциации Кд = 1,75 10-5, 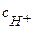 =αс0, где степень диссоциации
=αс0, где степень диссоциации 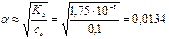 и тогда
и тогда 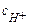

 моль/л,
моль/л,
следовательно 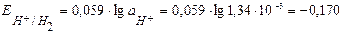 В.
В.
б) в растворе соляной кислоты: HCl → H+ + Cl–,
так как НСl является сильным электролитом, то ионная сила раствора:
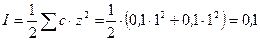 . Коэффициент активности
. Коэффициент активности  и тогда:
и тогда:
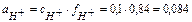 и
и 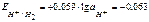 .
.
Т.к. 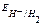 , рассчитанный для соляной кислоты больше, чем для уксусной кислоты, то катодом будет электрод, погруженный в раствор соляной кислоты, анодом – электрод, погруженный в раствор уксусной кислоты.
, рассчитанный для соляной кислоты больше, чем для уксусной кислоты, то катодом будет электрод, погруженный в раствор соляной кислоты, анодом – электрод, погруженный в раствор уксусной кислоты. 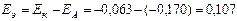 В.
В.
Основы электрохимической кинетики электродных процессов
Uхит < ЭДС Uэлектролиз.> Uразлож .
К.П.Д. < 100% Uразл = Еа – Ек

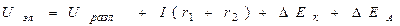
U – напряжение
I(r1 + r2) - омическое падение напряжения;
r1 - сопротивлениев проводниках с электронной проводимостью (проводники первого рода);
r2 - сопротивление в электролите (проводник второго рода);
∆Ек - поляризация катода
∆Еа - поляризация анода
Уменьшить омические потери можно:
· Уменьшая сопротивление проводников 1 и 2 рода (подбирая проводники с высокой удельной проводимостью)
· Уменьшая расстояние между катодом и анодом
· Повышая Т электролита
Поляризация D Е - отклонение потенциала электрода под током от его равновесного значения: D Е = Еi – Еp, D Е = Еi – Еp, D ЕA = ЕAi – ЕAp,
D ЕK = ЕKi – ЕKp. Для определения поляризации строят зависимости потенциала от тока – поляризационные кривые.
 Из закона Фарадея Þ ток (I) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции.
Из закона Фарадея Þ ток (I) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции.  Þ значение I для оценки скорости. Для получения большего тока Þ большее отклонение от равновесного значения Þ большее значение поляризации. Чем больше D Е Þ больше I Þ больше скорость
Þ значение I для оценки скорости. Для получения большего тока Þ большее отклонение от равновесного значения Þ большее значение поляризации. Чем больше D Е Þ больше I Þ больше скорость
Поэтому ток используют для оценки скорости, относя его к единице поверхности. Графическая зависимость Е = f (i) – это поляризационная кривая.

Поляризационные кривые в ХИТ
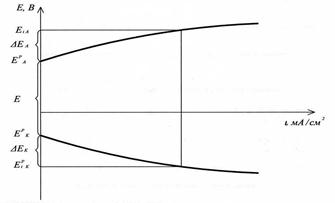
Поляризационные кривые при электролизе
При прохождении электрического тока: Е анода становится более положительным, Е катода - более отрицательным и напряжение Uхит – уменьшается, Uэл - увеличивается
VЭЛЕКТОХИМ.Р.= VЛИМ.СТ .
Стадии электрохимической реакции ( 1 и 3 – стадии массопереноса, 2 – стадия разряда-ионизации):
1. Подвод реагента к поверхности электрода
2. Собственно электрохимическая стадия
3. Отвод продуктов от поверхности электрода
Возникновение поляризации связано с замедленностью протекания реакции. Для уменьшения поляризации создают условия, при которых лимитирующая стадия протекает максимально быстро.
Стадии массопереноса -поляризация, обусловленная замедленностью этих стадий называется концентрационной, возникает за счет изменения концентрации реагентов в приэлектродном слое, что влияет на величину потенциала при прохождении тока
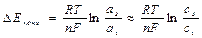
а s,v – активность ионов в приэлектродном слое (s) или в объеме раствора (v)
Так, в Zn–Cu ГЭ Еа смещается в «+» сторону, Ек – в «–» сторону, из-за Сv не равного Сs.
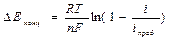
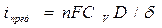
D – коэффициент диффузии реагента
d - толщина диффузионного слоя (тонкий слой около поверхности, где частицы переносятся путем диффузии)
D Е конц уменьшается, если: 1) увеличить D; 2) увеличить Сv; 3) уменьшить d; 4)перемешивать
Стадия разряда – ионизации - поляризацию, обусловленную замедленностью этой стадии (собственно электрохимической реакции) называют электрохимической (или перенапряжением).
Она связана с перестройкой структуры частиц в ходе приема или отдачи электронов которая возможна только для активных частиц. Чем больше энергия активация, тем большая поляризация требуется для обеспечения определенной скорости электрохимической реакции (i). Зависимость выражается уравнением Тафеля: D Е эл/х = а + вlgi
а - константа, зависящая от материала и поверхности электрода, температуры, рН, С и состава электролита,
в – константа, зависящая от природы реакции и Т.
На одинаковых материалах D Е эл/х уменьшается, если: увеличить Т, С, S.
На разных материалах D Е эл/х уменьшается, если: уменьшить Еакт., т. е. при использовании электродов-kt с большой S.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 673; Нарушение авторских прав?; Мы поможем в написании вашей работы!