
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Болезни гипоталамуса и гипофиза 2 страница
|
|
|
|
Эффекты массы крупных опухолей также с трудом устраняются с помощью только оперативного лечения, В тех случаях, когда операция была единственным методом, симптомы болезни в течение 10-летнего периода возобновились у 85% больных. При сочетании операции с лучевой терапией частота рецидивов за 10 лет составила 15%.
Смертность при операциях по поводу макроаденом составляет около 0,86%, а осложнения встречаются примерно в 6,3% случаев. Из них почти в 5% случаев наблюдается транзиторный, а в 1% — постоянный несахарный диабет. К тяжелым осложнениям операции по поводу макроаденомы относятся также ринорея спинномозговой жидкости (3,3%), необратимая потеря зрения (1,5%), стойкий паралич глазодвигательных нервов (0,6%) и менингит (0,5%).
Лучевая терапия. После проведения традиционной лучевой терапии рост опухоли прекращается у 70—100%) больных, тогда как быстро нормализовать функцию гипофиза удается у гораздо меньшего их числа. Лечение проводится с применением ротационных методик и заключается в подведении к гипофизу 4500 сГр (4500 рад) за 4,5—5 нед. У 50% больных с акромегалией через 5 лет и у 70%) через 10 лет уровни ГР становятся ниже 5 нг/мл. Обычное облучение в качестве монотерапии редко позволяет достичь успеха в лечении взрослых больных с кортикотропными аденомами. Отдаленные результаты облучения больных с пролактиномами в настоящее время изучаются. Осложнения традиционной лучевой терапии характеризуются гипопитуитаризмом, который развивается почти у 50%) больных.
Облучение тяжелыми нуклидами — протонным пучком или альфа-частицами — эффективный метод лечения больных с секретирующими аденомами, но эффект этот наступает достаточно медленно. Опухоли с супраселлярным распространением или инвазией окружающих тканей подобным образом обычно не облучают. При облучении протоновым пучком на гарвардском циклотроне можно давать до 14 000 сГр (14 000 рад) без риска повредить окружающие структуры. Через 2 года у 28% больных с акромегалией уровень ГР был ниже 5 нг/мл, через 5 лет — у 56%, а через 10 лет — у 75%. Облучение протоновым пучком при болезни Кушинга через 2 года привело к устранению гиперкортизолемии у 55%, а через 5 лет— у 80%о больных. Воздействие на организм протоновым пучком эффективно снижает уровень АКТГ и останавливает рост большинства кортикотропных аденом у больных с синдромом Нельсона, за исключением тех случаев, когда опухоли к началу лечения уже прорастают окружающие ткани. Отдаленных результатов лечения пролактином с помощью протонного пучка пока нет.
Осложнения терапии тяжелыми частицами, включая гипопитуитаризм, встречаются не менее чем у 10%о больных; точных данных о развитии отдаленных осложнений нет. Примерно у 1,5%о больных отмечались обратимые дефекты полей зрения и глазодвигательные нарушения. Основной недостаток этого вида лечения заключается в значительной отсроченности нормализации секреции гормонов.
Для лечения микропролактином мы, как правило, применяем бромкриптин. Однако тем больным с микропролактиномами, которые нуждаются в лечении, но не переносят агонистов дофамина, мы рекомендуем оперативное вмешательство. При этом относительно доброкачественном заболевании операция обычно не приводит к гипопитуитаризму. У больных с акромегалией или болезнью Кушинга средством выбора мы считаем операцию, поскольку в большинстве случаев необходимо добиться достаточно быстрого прекращения гиперсекреции гормонов. Так как болезнь Кушинга и акромегалия потенциально смертельны, может потребоваться более обширная операция, приводящая к гипопитуитаризму.
Многие больные с макропролактнномами принимают только бромкриптин; эта схема лечения заслуживает внимания, и ее необходимо попытаться использовать. Транссфеноидальную операцию и/или лучевую терапию при крупных пролактиномах мы рекомендуем в случаях планирования беременности, наличия постоянных структурных нарушений или сохранения симптомов гиперпролактинемии, несмотря на прием агонистов дофамина, а также при непереносимости дофаминергических средств. Больным с нефункционирующими аденомами гипофиза при наличии структурных изменений требуется транссфеноидальная операция, как правило, с последующей традиционной лучевой терапией. Альтернативным методом лечения больных акромегалией или болезнью Кушинга, у которых имеются противопоказания к операции или которые отказываются от ее проведения, является облучение тяжелыми частицами. Воздействие на организм тяжелыми частицами или традиционное облучение эффективны в том случае, если после транссфеноидальной операции сохраняется повышенный уровень ГР. Облучение тяжелыми частицами эффективно также при сохранении болезни Кушинга. Облучение протоновым пучком успешно применяется при лечении большинства больных с синдромом Нельсона и может иметь преимущества перед традиционным облучением при лечении больных с макронролактиномамн и несекретирующими макроаденомами. Иногда, особенно при гигантских аденомах, требуется трансфронтальная операция.
Гипопитуитаризм. Гипопитуитаризмом называют недостаточность одного или более гипофизарных гормонов. Известно много причин гипопитуитаризма (табл. 321-6).
Недостаточность гипофизарных гормонов может быть врожденной и приобретенной. Часто встречается изолированная недостаточность ГР или гонадотропинов. Нередко имеет место и временная недостаточность АКТГ как результат длительной глюкокортикоидной терапии, но постоянная изолированная недостаточность АКТГ или ТТГ встречается редко. Недостаточность любого гормона передней доли гипофиза может обусловливаться патологией как гипофиза, так н гипоталамуса. При наличии несахарного диабета первичный дефект почти всегда локализуется в гипоталамусе или в верхних отделах ножки гипофиза; часто при этом наблюдаются также легкая гиперпролактинемия и гипофункция передней доли гипофиза.
Проявления гипопитуитаризма зависят оттого, недостаточность каких гормонов имеется в конкретном случае. Малорослость. обусловленная дефицитом ГР, — достаточно широко распространенный симптом у детей. Недостаточность ГР у взрослых лиц проявляется менее заметно — тонкими морщинками вокруг глаз н рта, а у больных сахарным диабетом — повышенной чувствительностью к инсулину. Недостаточность гонадотропинов характеризуется аменореей н бесплодием у женщин, признаками снижения уровня тестостерона, снижением либидо, уменьшением роста волос на подбородке п геле и сохранением детской линии оволосения головы — у мужчин. Недостаточность ТТГ сопровождается гипотиреозом с утомляемостью, непереносимостью холода н одутловатостью кожи в отсутствие зоба. Недостаточность АКТГ приводит к дефициту кортизола, проявляющемуся слабостью, потерей аппетита, снижением массы тела; уменьшению пигментированности кожи и грудных сосков; нарушению реакции на стресс (что характеризуется лихорадкой, гипотензией и гипонатриемией) и повышению смертности. В отличие от первичной недостаточности коры надпочечников (аддисонова болезнь) недостаточность АКТГ не сопровождается гиперпигментацией, гиперкалиемией или нарушением водно-солевого обмена. У больных с сочетанной недостаточностью АКТГ и гонадотропинов выпадают волосы под мышками и на лобке. У детей с комбинированной недостаточностью ГР н кортизола часто развивается гипогликемия. Дефицит АВП вызывает несахарный диабет с полиурией и усиленной жаждой. В тех случаях, когда аденомы гипофиза обусловливают дисфункцию его передней доли, в первую очередь нарушается секреция ГГ, а затем гонадотропинов. ТТГ н АКТГ.
Причины. Патология передней доли гипофиза связана обычно с аденоматозным ростом (с инфарктом или без него), операцией на гипофизе, его облучением тяжелыми частицами или инфарктом в послеродовом периоде (синдром Шихена). Послеродовой инфаркт гипофиза возникает в связи с тем, что увеличенная во время беременности железа особенно предрасположена к ишемии; послеродовое кровотечение с системной гипотензией в таких условиях может служить причиной ишемического инфаркта гипофиза. Первым и наиболее частым клиническим признаком является неспособность к лактации, тогда как другие симптомы гипопитуитаризма могут оставаться скрытыми в течение месяцев и лет. Это состояние иногда диагностируют спустя годы после инфаркта гипофиза. Хотя клинические
Таблица 321-6. Причины гипопитуитаризма
Изолированная недостаточность гормонов (врожденная или приобретенная) Опухоли (крупные аденомы гипофиза; апоплексия гипофиза; опухоли гипоталамуса, например краниофарингиомы, герминомы, хордомы, менингиомы, глиомы и др.) Воспалительные процессы [гранулемные заболевания, например саркоидоз, туберкулез, сифилис, гранулематозный гипофизит: гистиоцитоз X; лимфоцитарный гипофизит
(аутоиммунный)] Сосудистые заболевания (послеродовой некроз Шихена;? околородовой диабетический некроз; аневризма сонной артерии) Деструктивно-травматические процессы [хирургическая операция; отрыв ножки гипофиза; облучение (традиционное — гипоталамус; тяжелыми частичами — гипофиз)] Пороки развития (аплазия гипофиза; энцефалоцеле основания мозга) Инфильтративные процессы (гемохроматоз; амилоидоз) «Идиопатические» случаи (? аутоиммунные процессы)
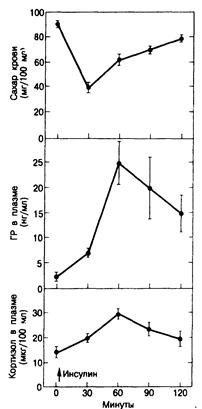
Рис. 321-8. Тест толерантности к инсулину.
После внутривенного введения обычного инсулина (0,1 ЕД/кг массы тела) ожидается падение уровня сахара в крови и повышение концентрации ГР и кортизола в плазме. Этот тест позволяет оцепить резервы как ГР, так и АКТГ у больных с заболеваниями гипофиза. (По К. J. Catt. Lancet, 1970, 1:933.)
проявления несахарного диабета в таких случаях редки, часто наблюдается снижение реакции АВП на соответствующие стимулы. Больные сахарным диабетом также предрасположены к развитию гипопитуитаризма на поздних стадиях беременности.
Другой причиной гипопитуитаризма является лимфоцитарный гипофизит — синдром, развивающийся обычно во время беременности или в послеродовом периоде. При этом синдроме КТ-сканирование часто позволяет обнаружить в гипофизе некую массу, которая при биопсии оказывается лимфоидным инфильтратом. Считают, что лимфоцитарный гипофизит представляет собой аутоиммунное разрушение гипофиза, которому часто сопутствуют другие аутоиммунные заболевания, такие как тиреоидит Хашимото (аутоиммунный) и атрофия слизистой оболочки желудка (см. гл. 334). У некоторых из таких больных в крови обнаруживаются антитела к пролактотрофам. Хотя выявлено всего меньше 20 случаев лимфоцитарного гипофизнта, антитела к пролактину присутствуют в сыворотке примерно 7% больных с другими аутоиммунными заболеваниями. Неясно, как часто аутоиммунный гипофизит служит причиной «идиопатического» гипопитуитаризма у взрослых лиц.
Повреждение гипоталамуса или ножки гипофиза может быть обусловлено многими причинами (см. табл. 321-6). Некоторые процессы в этой области, такие как саркоидоз, метастазы рака, герминомы, гистиоцитоз и краниофарингиомы, обычно вызывают не только гипофункцию передней доли гипофиза, но и несахарный диабет. Недостаточность гипофиза после обычного облучения мозга или гипофиза относят в основном на счет повреждения гипоталамуса.
Диагностика (см. табл. 321-5). При диагностике недостаточности ГР наиболее надежным стимулятором его секреции является инсулиновая гипогликемия, при которой уровень сахара в крови падает ниже 40 мг/дл (400 мг/л) (рис. 321-8). Если после эпизода гипогликемии, введения леводопы или аргинина концентрация ГР превышает 10 нг/мл. можно исключить наличие дефицита ГР. Определение базальных концентраций ГР или ИФР-1/СМ-С в сыворотке крови менее надежно, поскольку у здорового человека уровень ГР на протяжении большей части суток ниже предела чувствительности метода, а содержание ИФР-1/СМ-С у больных с недостаточностью ГР перекрывается нормальными величинами.
Недостаточность кортизола потенциально опасна для жизни. Базальный уровень кортизола может сохраняться, несмотря на выраженную патологию гипофиза; поэтому необходимо оценивать способность гипофиза увеличивать секрецию АКТГ в ответ на стресс. Для определения адекватности резервов АКТГ можно использовать тест толерантности к инсулину (инсулиновая проба) или метопироновый тест.
В амбулаторных условиях тест толерантности к инсулину без какой-либо опасности можно проводить лицам молодого или среднего возраста, не страдающим заболеваниями сердца и без предрасположенности к судорожным припадкам (см. рис. 321-8 и табл. 321-5). Определяют реакцию как ГР. так и кортизола. При подозрении на гипопитуитаризм следует вводить меньшие дозы обычного инсулина (0,05—0,1 ЕД/кг массы тела). После воспроизведения гипогликемии достаточной степени максимум концентрации кортизола в плазме должен превышать 19 мкг/дл (190 мкг/л), хотя предлагаются и другие критерии. Поскольку у больных с пониженной базальной скоростью секреции кортизола метопироновый тест может вызвать острую недостаточность надпочечников, его следует проводи ть в условиях клиники, когда базальная концентрация кортизола в сыворотке в 8 ч утра ниже 9 мкг/дл (90 мкг/л). Кроме того, введению метопирона у большинства больных должен предшествовать быстрый стимуляционный тест с АКТГ, позволяющий удостовериться в способности надпочечников реагировать на АКТГ. У больных с базальным уровнем кортизола в плазме в 8 ч утра 4—5 мкг/дл (40—50 мкг/л) метопироновый тест проводить нельзя. Нормальная реакция на введение метопирона (см. табл. 321-5) характеризуется возрастанием уровня 11-гидроксикортизола в плазме выше 10 мкг/дл, а содержания 17-гидроксистероидов в моче — не менее чем в 2 раза по отношению к базальному, обычно до величин, превышающих 22 мг за сутки. Уровень кортизола в плазме должен одновременно падать ниже 4 мкг/дл (40 мкг/л), чтобы быть уверенным в достаточности стимула для секреции АКТГ. Хотя реакции АКТГ на инсулиновую гипогликемию и метопирон недостаточно стандартизованы, нормальной считают пиковую концентрацию АКТГ выше 200 пг/мл.
Быстрый стимуляционный тест с АКТГ может быть более безопасным и удобным для проверки сохранности функции гипофизарно-надпочечниковой системы, нежели инсулинотолерантный или метопироновый тесты. Поскольку реакция надпочечников на экзогенный АКТГ зависит от предшествующего действия эндогенного АКТГ, у больных с резким дефицитом АКТГ в действительности снижается реакция надпочечников и на экзогенный АКТГ. Однако быстрый стимуляционный тест с АКТГ у некоторых больных с нарушенной инсулиновой пробой может оставаться нормальным и поэтому не выявлять всех тех, кто подвержен риску развития недостаточности надпочечников при стрессе. Таким образом, если тесты на секреторные резервы АКТГ выявляют нарушение в гипофизарно-надпочечниковой системе, то нормальная реакция на быстрый стимуляционный тес г с АКТГ [уровень кортизола выше 19 мкг/дл (190 мкг/л)] не всегда позволяет исключить такое нарушение.
Гонадотропную функцию гипофиза оценить легче. У женщин с регулярными менструациями секреция гонадотропинов заведомо нормальна, и определять эти гормоны излишне. Точно так же у мужчин с нормальным уровнем тестостерона в сыворотке крови и нормальным сперматогенезом не требуется определять содержание гонадотропинов. У женщин в постклимактерическом периоде уровень гонадотропинов повышен (эндогенный стимуляционный тест): «нормальный» их уровень в таких условиях свидетельствует о недостаточности гонадотропинов. Дефицит эстрогенов у женщин и тестостерона у мужчин без повышения содержания гонадотропинов и означает их недостаточность.
Для диагностики центрального гипотиреоза прежде всего следует определить уровень Т4 и свободного Т4 в сыворотке крови (или поглощение Т3 смолой и индекс свободного Т3). Если эти показатели соответствуют средним нормальным, то и ТТГ-функция нормальна. Если же содержание Т4 и свободного Т4 снижено, а уровень ТТГ в сыворотке не повышен, то имеет место центральный гипотиреоз. Диагноз легкого центрального гипотиреоза устанавливают у лиц с заболеванием гипофиза и уровнями Т4 и свободного Т4, находящимися на нижней границе нормы. Прежде чем ставить диагноз изолированной недостаточности ТТГ у больных с биохимическими признаками центрального гипотиреоза в отсутствие симптомов недостаточности других гипофизарных гормонов, необходимо исключить синдром недостаточности тироксинсвязывающего глобулина (ТСГ) (сниженный уровень Т4. повышенное поглощение Т3 смолой, низкий или на нижней границе нормы индекс свободного Т4, нормальный уровень ТТГ) и синдром «эутиреоидной патологии» (низкий уровень Т4, низкий уровень свободного Т4 или индекс свободного Т4, нормальное содержание ТТГ) (см. гл. 324).
Некоторые диагностические тесты для оценки гипофизарных резервов проводят с использованием гипоталамических рилизинг-гормонов. Хотя эти тесты не помогают оценить адекватность функции передней доли гипофиза, в ряде ситуаций они оказываются полезными. При дефиците ГР у детей реакция ГР на ГРГ позволяет выбрать метод лечения конкретного больного — с помощью ГРГ или ГР. Подобно этому, у больных с изолированной недостаточностью гонадотропинов реакция последних на ЛГРГ помогает спрогнозировать результаты лечения аналогами ЛГРГ. Тест с КРГ может быть полезным при дифференциальной диагностике синдрома Кушинга, но не позволяет выяснить, будет ли гипофизарно-надпочечниковая система должным образом реагировать на стресс. Стимуляционный тест с ТРГ у некоторых больных способствует подтверждению диагноза гипертиреоза или акромегалии, а также информативен в тех случаях, когда нужно документировать недостаточность пролактина, чтобы подтвердить диагноз более генерализованной недостаточности гормонов передней доли гипофиза (например, при легком центральном гипотиреозе). Тест с ТРГ не требуется для диагностики центрального гипотиреоза и недостаточно надежен для разграничения гипофизарного и гипоталамического гипотиреоза.
Лечение. Больным с пангипопитуитаризмом можно вводить недостающие гормоны, но наиболее важна заместительная терапия кортизолом. Исходя из соображений удобства и цены, мы предпочитаем преднизон, но многие врачи применяют кортизона ацетат. Преднизон (5—7.5 мг) или кортизона ацетат (20—37,5 мг) можно назначать одним больным в виде одноразовой утренней дозы, тогда как другие требуют дробных доз (две трети в 8 ч утра и одна треть в 3 ч yтpa). Больные гипопитуитаризмом нуждаются в меньших суточных дозах глюкокортикоидов, чем больные с аддисоновой болезнью, и не требуют заместительной терапии минералокортикоидами. В стрессовых ситуациях или в периоды подготовки таких больных к хирургическим операциям на гипофизе или других органах дозы глюкокортикоидов нужно увеличивать (например, при крупных операциях вводить гидрокортизона гемисукцинат в дозе 75 мг внутримышечно или внутривенно каждые 6 ч или метилпреднизолона натрия сукцинат в дозе 15 мг внутримышечно или внутривенно каждые 6 ч), У больных с центральным гипотиреозом наиболее эффективен левотироксии (0,1—0,2 мг в сутки). Поскольку тпроксии ускоряет распад кортизола и может вызвать адреналовый криз у больных с ограниченными резервами гипофиза, при пангипопитуитаризме лечению левотироксином всегда должна предшествовать заместительная терапия глюкокортикоидами. Женщин с гипогонадизмом лечат эстрогенами в сочетании с прогестагенами, мужчин — инъекциями эфиров тестостерона. Для обеспечения фертильности больным с заболеваниями гипофиза нужно инъецировать гонадотропины, а больным с патологией гипоталамуса могут помочь ЛГРГ и его аналоги. Дефицит ГР у взрослых не поддается коррекции; у детей обычно требуется введение ГР, но в случаях патологии гипоталамуса эффективными могут быть инъекции ГРГ. При несахарном диабете больным вводят десмопрессин через нос (обычно 0,05—0,1 мл дважды в сутки) (см. гл. 323).
Рентгенология гипофиза. Контуры турецкого седла видны на обычных рентгенограммах черепа в заднепередней и боковой проекциях (рис. 321-9). На таких снимках можно выявить увеличение, эрозии и кальцификации в области турецкого седла. Чтобы получить более детальное представление о внутригипофизарных и супраселлярных повреждениях, необходимо использовать КТ-сканирование и магнитную резонансографию (МРГ). В тех случаях, когда в качестве причины увеличения турецкого седла подозревают аневризму или сосудистую аномалию, выполняют ангиографию. Последняя иногда необходима и у больных с крупными опухолями гипофиза или гипоталамуса. Для получения изображения супраселлярной области вместо пневмоэнцефалографии все чаще используют цистернографию с метризамидом, т. е. КТ-сканирование производят после интратекальной инъекции водорастворимого красителя метризамида. Томография турецкого седла не рекомендуется, так как она очень часто даст ложноположительные и ложноотрицательные результаты, кроме того, хрусталики глаз подвергаются чрезмерной лучевой нагрузке. В конце концов современные методы исследования гипофиза могут быть вытеснены МРГ (рис. 321-10).
У больных с микроаденомами гипофиза объем турецкого седла (233—1092 мм3, в среднем 594 мм3) не меняется. При обычной рентгенографии микроаденомы можно заподозрить на основании очаговых эрозий или пузырьков на дне турецкого седла, но иногда подобная картина наблюдается и у здоровых лиц. Более крупные микроаденомы могут обусловливать «наклон» дна турецкого седла, видимый во фронтальной проекции, и «двойное дно» — в сагиттальной (рис. 321-11).
Поскольку при большинстве микроаденом объем турецкого седла не изменяется и отсутствуют специфические рентгенологические признаки, выявлять подобные опухоли необходимо при помощи КТ-сканирования с высоким разрешением (рис. 321-12). При КТ-сканированпи видно, что нормальный гипофиз имеет высоту 3—7 мм. Его верхний край плоский или вогнутый. Ножка гипофиза располагается по средней линии, и ее диаметр в аксиальной проекции составляет 4 мм. При внутривенном введении контрастного вещества нормальный гипофиз у 60% здоровых лиц выглядит гомогенным, а у 40° о — гетерогенным образованием. Почти у 20% здоровых лиц при КТ-сканировании с контрастным веществом в гипофизе видны отдельные участки пониженной плотности. При анализировании случайной выборки аутопсийного материала обнаруживают небольшие аномалии гипофиза (например, микроаденомы, кисты, метастазы рака, инфаркты) почти у 24% лиц,
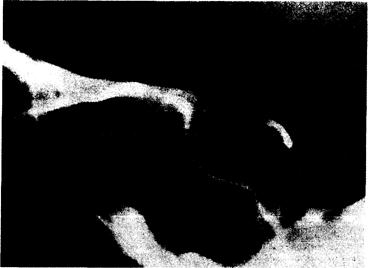
Рис. 321 -9. Рентгенограмма турецкого седла (вид сбоку).
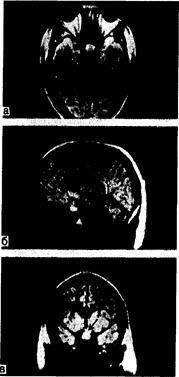
Рис. 321-10. Магниторезонансограммы (МРГ) больного с крупной аденомой гипофиза (показана стрелкой) в аксиальной (а), сагиттальной (б) и корональной (в) проекциях. (По G. Gerardetal.Hosp.Pract., 1984, 19:151.)
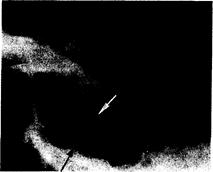
Рис. 321-11. Боковая КТ-сканограмма турецкого седла (в сагиттальной проекции).
Видно «двойное дно» из-за смещения его книзу под действием аденомы гипофиза. Верхней стрелкой показано нормальное дно; нижней стрелкой —дно. смещенное опухолью.
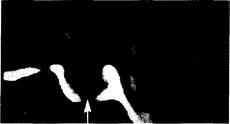
Рис. 321-12. КТ-сканограмма турецкого седла (в сагиттальной проекции) у больного с небольшой микропролактиномой (показана стрелкой.)
Опухоль обладает пониженной плотностью, видна незначительная эрозия дна турецкого седла. Опухоль показана стрелками.
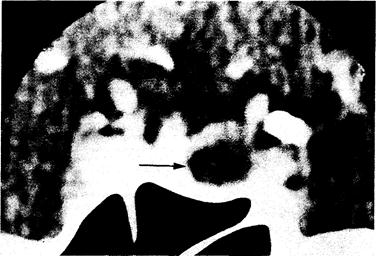
Рис. 312-13. КТ-сканограмма (в корональной проекции) у женщины в возрасте 30 лет.
Видна макропролактинома диаметром 1,3 см. Можно отметить пониженную плотность опухоли (стрелка). Ножка гипофиза смещена влево; дно турецкого седла также наклонено влево. но неизвестно, проявляются ли такие аномалии очаговыми изменениями при КТ-сканировании.
Микроаденомы лучше всего выявляются на прямых поперечных срезах, получаемых через 1 мм после быстрого введения контрастного вещества. Плотность нормального гипофиза повышена, но все же она меньше, чем плотность кавернозного синуса. Микроаденомы, особенно микропролактиномы, при исследовании этим методом выглядят обычно еще менее плотными (см. рис. 321-12). Особенно трудно увидеть мелкие кортикотропные аденомы. Более крупные микроаденомы могут обусловливать выпуклость диафрагмы турецкого седла вверх и контралатеральное смещение ножки гипофиза (рис. 321-13). Если выявлено выраженное увеличение интраселлярного пространства, то для исключения аневризмы или трансселяриого межкаротидного анастомоза необходимо провести ангиографию.
Макроадсномы гипофиза, как правило, вызывают увеличение турецкого седла с эрозией костей или без нее, что видно на обычных рентгенограммах. Однако наличия расширенного турецкого седла недостаточно для установления диагноза аденомы гипофиза (см. ниже). В качестве дополнительных признаков на плоских рентгенограммах черепа у больных акромегалией обнаруживают прогнатизм, увеличение параназальных пазух, гиперостоз наружного затылочного бугра, повышение плотности центральной кости турецкого седла и увеличение его площади с заострением бугорка. ГР-секретирующие аденомы могут подвергаться кальцификации и регрессировать, оставляя после себя гипофизарный камень. Более крупные кортикотропные аденомы приводят к опущению дна турецкого седла.
При КТ-сканировании у больных с макроаденомами в турецком седле обнаруживают массу, которая после введения контрастного вещества обычно приобретает большие размеры (см. рис. 321-5). Почти у 20% больных внутри этой увеличенной массы выявляют область с пониженной плотностью, что указывает на кистозную дегенерацию аденомы. Еще у 20% больных с макроаденомами турецкое седло частично пустое, причем плотность внутри него соответствует плотности СМЖ (см. ниже). Более крупные инвазивные опухоли могут распространяться в кавернозный синус, пазуху основной кости или в любую черепную ямку. Гиперплазия гипофиза (например, гиперплазия тиреотрофов при первичном гипотиреозе) при КТ-сканировании дает картину увеличенного заполненного турецкого седла, размеры которого после введения контрастного вещества не возрастают.
Апоплексию гипофиза вызывает внезапное увеличение размеров макроаденом вследствие кровоизлияния или ин4заркта. На плоскостных снимках почти всегда видно увеличение турецкого седла. В случае кровоизлияния при КТ-сканировании в острой фазе в аденоме обнаруживают область высокой плотности, а после рассасывания гематомы — низкой плотности с краевым увеличением или без него после введения контраста. При инфаркте видны области низкой плотности также с увеличением или без него после введения контраста.
Выявление на плоскостных рентгенограммах черепа на основании узелковой или криволинейной кальцификации в супраселлярной области позволяет заподозрить краниофарингиому (рис. 321 -14). Подобную кальцификацию обнаруживают у 80—90% больных детей, но менее чем у 50% взрослых больных. Хотя турецкое седло может быть увеличено и растянуто, кортикальная кость обычно сохраняется. При внутриселлярных краниофарингиомах спинка турецкого седла часто смещена назад. При КТ-сканировании почти у всех больных детей и у 80% взрослых больных отчетливо видны кистозные участки с кольцом узелковой кальцификации. Некистозные области после введения контрастного вещества так или иначе увеличиваются; у детей это особенно заметно.
Большинство менингиом области турецкого седла вызывают изменения, видимые на обычных рентгенограммах черепа. Это кальцификация опухоли и гиперостоз пластинки
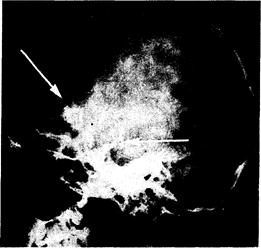
Рис. 321-14. Боковая рентгенограмма черепа (в боковой проекции)у больного с краниофарингиомой.
Можно видеть плотную кальцификацию в области, расположенной над турецким седлом (стрелка).
основной кости и борозды зрительного перекреста. Менингиомы могут также вызывать увеличение турецкого седла и тем самым имитировать картину аденом гипофиза. На КТ-сканограммах менингиомы иногда имеют вид аневризм в силу гомогенного увеличения их плотности после введения контрастного вещества. Для исключения аневризмы и визуализации питающих сосудов может потребоваться ангиография.
Аневризмы в области турецкого седла содержат концентрические кальцификаты, видимые на плоскостных рентгеновских снимках черепа почти у 30% больных. Аневризмы могут вызывать увеличение турецкого седла, обычно с латеральным опущением и эрозией его дна; поэтому в боковых проекциях видно «двойное дно». На КТ-сканограммах выявляют повышенную плотность аневризмы с гомогенным увеличением после введения контрастного вещества. Большинство больных с очень плотными образованиями, увеличивающими турецкое седло, требуют обследования с помощью методики количественного вычитания или обычной ангиографии. При тромбировании аневризмы картина на КТ может меняться: размеры новых тромбов не увеличиваются после введения контрастного вещества, тогда как старые увеличиваются подобно аденомам. Полный тромбоз аневризмы иногда невозможно рентгенологически отличить от аденомы гипофиза.
К видимым при КТ-скапировании увеличивающимся после введения контрастного вещества массам в супраселлярной области относятся глиомы перекреста зрительных нервов или гипоталамуса, метастазы в гипоталамус или ножку гипофиза, герминомы, сарко-идные гранулемы, гистиоцитоз, аневризмы и краниофарингиомы. К массам, не увеличивающимся после введения контрастного вещества, относятся дермоидные и эпидермоидные опухоли и кисты арахноидального пространства.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 698; Нарушение авторских прав?; Мы поможем в написании вашей работы!