
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розрахунок
|
|
|
|
Теплота випаровування етилового спирта залежно від температури
Поверхневий натяг етилового спирта і його водних розчинів, мн/м
В’язкість етилового спирта і його водних розчинів, мПа·с
| Кон-цен-тра-ція, % | Температура, ºС | |||||||||||
| -20 | -10 | |||||||||||
| 2,38 – – – – | 2,23 – – – – | 1,78 3,69 5,75 7,14 5,32 | 1,46 2,71 3,77 4,39 3,17 | 1,19 2,01 2,67 2,91 2,18 | 1,0 1,53 1,93 2,02 1,55 | 0,825 1,2 1,45 1,48 1,16 | 0,701 0,97 1,13 1,13 0,91 | 0,591 0,79 0,9 0,89 0,74 | 0,435 0,57 0,6 0,6 0,51 | 0,326 0,52 0,45 0,44 0,38 | 0,248 0,43 0,34 0,34 0,3 |
Таблиця ІІІ.9
Густина етилового спирта і його водних розчинів, кг/м3
| Концентра-ція, % | Температура, ºС | |||||||
| -20 | ||||||||
| – – – – |
Таблиця ІІІ.10
| Кон-цен-трація, % | Температура, ºС | |||||||
| -20 | ||||||||
| 25,7 – – – – | 22,3 | 20,6 | 17,3 | 15,5 | 13,4 |
Таблиця ІІІ.11
Теплоємність етилового спирта і його водних розчинів, кДж/кг∙град
| Кон-центра-ція, % | Температура, ºС | |||||||
| –20 | ||||||||
| 2,12 – – – – | 2,29 2,68 3,06 3,44 3,81 | 2,485 2,85 3,14 3,52 3,85 | 2,715 3,02 3,31 3,65 3,9 | 2,966 3,23 3,48 3,69 3,94 | 3,222 3,44 3,60 3,81 3,98 | 3,515 3,65 3,77 3,94 4,06 | 3,809 3,9 3,98 4,02 4,11 |
Література: [1, 4, 6–11]
Примітка. Розрахунок ректифікаційних установок пов’язаний із необхідністю підбору за довідниками значень фізичних та фізико-хімічних властивостей і параметрів для заданої суміші.
У табл. ІІІ. 7 – ІІІ. 13 наводяться ці дані для етилового спирта і води.
Таблиця ІІІ.12
| Темпера-тура, ºС | ||||||||
| Теплота випаро-вування, кДж/кг | 921,8 | 913,4 | 900,8 | 850,6 | 712,3 |
Таблиця ІІІ.13
Питома теплоємність с, кДж/кг∙град, в’язкість μ, мПа·с,
і теплопровідність  , Вт/м∙град, парів етилового спирта
, Вт/м∙град, парів етилового спирта
залежно від температури
| Темпера-тура, ºС | |||||||

| 1,34 0,00785 0,013 | 1,689 0,0108 0,023 | 2,01 0,0137 0,035 | 2,32 0,0167 0,050 | 2,62 0,0197 0,067 | 2,895 0,0226 0,0859 | 3,168 0,0257 0,108 |
Складаємо принципову схему ректифікаційної установки (рис. ІІІ.17) і наносимо на неї значення заданих величин. Потім визначаємо кількість дистиляту і кубового залишку.
Рівняння матеріального баланса для всієї суміші:
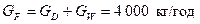 ,
,
де  – кількість вихідної суміші, кг/год,
– кількість вихідної суміші, кг/год,  – кількість дистиляту, кг/год;
– кількість дистиляту, кг/год;
 – кількість кубового залишку, кг/год.
– кількість кубового залишку, кг/год.
Рівняння матеріального баланса для НК:
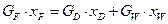 ,
,
або  .
.
Сумісне вирішення цих рівнянь дає:
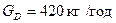 і
і  .
.
Визначимо теоретичну кількість тарілок, за якої забезпечується повна фізико-хімічна рівновага між стікаючою з тарілки рідиною і парою, що піднімається за повного перемішування рідини на тарілці і рівномірного розприділення пари за її перерізом.
Розрахунок виконуємо графічним способом з побудовою ступенів зміни концентрації [1].
Для виконання розрахунку за цим методом необхідно побудувати у–х- діаграму. Визначаємо молярні частки компонентів в рідині і у рівноважній парі х і у.
Молекулярні маси компонентів: етилового спирта і води:
 .
.
Молярна частка етилового спирта (С2Н5ОН) у початковій суміші:
 .
.

Рис. ІІІ.17. Схема установки для безперервної перегонки суміші
етиловий спирт – вода: 1 – теплообмінник; 2 – кубовий підігрівач;
3 – ректифікаційна колона; 4 – дефлегматор; 5 – сепаратор; 6 – конденсатор
Молярна частка етилового спирта (С2Н5ОН) у дистиляті:
 .
.
Молярна частка етилового спирта (С2Н5ОН) у кубовому залишку:
 .
.
За даними табл. ІІІ.7 будуємо криву рівноваги суміші, що розділяється. На у–х -діаграмі (рис. ІІІ.18) проводимо діагональ ОК і вертикальні прямі:
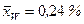 ;
;  ; і
; і 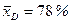 .
.

Рис. ІІІ.18. Діаграма рівноваги для бінарної суміші етиловий спирт – вода
Зазначаємо точки W і N (перетину діагоналей відповідно з першою та третьою прямою) і точку F 1 перетину другої прямої з кривою рівноваги. Знайденій точці F 1 відповідає концентрація спирта у парі, що знаходиться у рівновазі з рідиною,  за концентрації спирта в рідині
за концентрації спирта в рідині 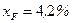 .
.
Визначаємо мінімальне значення флегмового числа  за формулами (ІІІ.10):
за формулами (ІІІ.10):
 .
.
Приймаючи, згідно із завданням, коефіцієнт надлишку флегми β = 2, знаходимо значення робочого флегмового числа:
 .
.
На діаграмі ух відкладаємо відрізок ОМ = В, причому
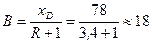 .
.
Як робочу лінію зміцнювальної частини колони проводимо на у–х -діаграмі пряму MN. Точку перетину цієї прямої з абсцисою  з’єднуємо з точкою W, внаслідок чого отримуємо робочу лінію FW вичерпної частини колони. Ці прямі виражаються наступними рівняннями.
з’єднуємо з точкою W, внаслідок чого отримуємо робочу лінію FW вичерпної частини колони. Ці прямі виражаються наступними рівняннями.
Робоча лінія зміцнюючої частини колони:
 .
.
Робоча лінія вичерпної частини колони
 ;
;
тут х і у – поточні значення координат; 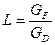 – кількість вихідної суміші на одиницю готового продукта.
– кількість вихідної суміші на одиницю готового продукта.
За у–х -діаграмою (рис. ІІІ.18) визначаємо теоретичну кількість тарілок (ступенів зміни концентрації). Для цього будуємо ступінчасту лінію, що складається із горизонтальних і вертикальних відрізків, у межах зміни х від 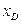 до
до 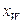 .
.
Кількість ступенів, що відповідає теоретичній кількості тарілок:
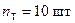 .
.
Для визначення реальної кількості тарілок необхідно визначити коефіцієнт корисної дії тарілки 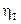 :
:
 .
.
За [4] ККД тарілки змінюється в широких межах, від 0,2 до 0,9. Його можна визначити за графіком, поданим на рис. ІІІ. 4, або розрахувати за рівнянням 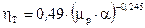 , що описує цей графік. Тут
, що описує цей графік. Тут  – в’язкість рідини, що розділяється, сП;
– в’язкість рідини, що розділяється, сП;  – відносна леткість.
– відносна леткість.
За табл. ІІІ.8 для температури кипіння вихідної суміші  знаходимо
знаходимо  = 0,34 сП.
= 0,34 сП.
Відносну леткість визначаємо [5] за формулою:
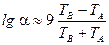 ,
,
де  ,
, 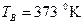 – температури кипіння компонентів.
– температури кипіння компонентів.
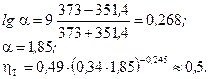
Отже, у вичерпній частині колони буде 8 тарілок, у зміцнювальній – 12, а разом 20 тарілок. Ця кількість робочих тарілок буде однаковою для всіх трьох типів колони (ККД ковпачкових тарілок залежить також від відстані між тарілками і може бути точно визначений за [6, 10]).
Для визначення розмірів колони визначаємо середнє значення основних параметрів парової суміші і рідини в колоні.
Кількість пари, що піднімається:
 .
.
Кількість стікаючої рідини у зміцнювальній частині колони і залежить від флегмового числа та становить:
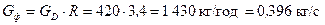 .
.
Кількість стікаючої рідини у вичерпній частині колони:
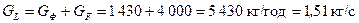 .
.
За робочою лінією у–х -діаграми (рис. ІІІ.18) визначаємо склад пари в точці F, що відповідає складу вихідної суміші, потім знаходимо середню мольну частку пари у верхній частині колони:
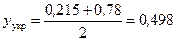 .
.
Середня мольна частка пари в нижній частині колони:
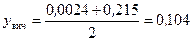 .
.
Середня мольна частка пари в колоні:
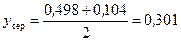 .
.
За фазовою t–x-д іаграмою (рис. ІІІ.19) знаходимо, що величині 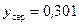 відповідає температура пари
відповідає температура пари  .
.

Рис. ІІІ. 19. Фазова діаграма для бінарної суміші “етиловий спирт – вода”
Середня густина пари за  і
і  за рівнянням стану становить:
за рівнянням стану становить:

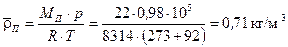 ,
,
де  – універсальна газова стала,
– універсальна газова стала, 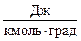 ;
;  – середня молекулярна маса пари, що має концентрацію
– середня молекулярна маса пари, що має концентрацію  і визначається за співвідношенням:
і визначається за співвідношенням:
 де
де  – мольна частка спирта в рідині за
– мольна частка спирта в рідині за  ; точніше її значення можна розрахувати за формулою:
; точніше її значення можна розрахувати за формулою:
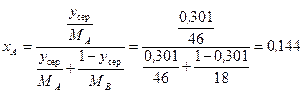 .
.
Об’ємна витрата пари становить:
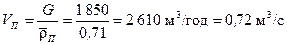 .
.
Середня мольна частка рідини у верхній частині колони:
 .
.
Густина рідини у верхній частині колони:

де  і
і  – густини низькокиплячого (спирта) і висококиплячого (води) компонентів за
– густини низькокиплячого (спирта) і висококиплячого (води) компонентів за 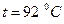 (табл. ІІІ.9).
(табл. ІІІ.9).
Середня мольна частка рідини у нижній частині колони:
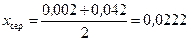 .
.
Густина рідини в нижній частині колони:
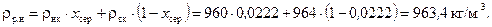
Середня густина рідини у колоні:
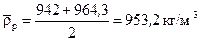 .
.
Об’ємна витрата рідини у верхній частині колони:

 .
.
Об’ємна витрата рідини у нижній частині колони:
 .
.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 647; Нарушение авторских прав?; Мы поможем в написании вашей работы!