
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окисление углерода
|
|
|
|
Важнейшие реакции сталеплавильных процессов
Металлический расплав
Получаемый сплав содержит различные примеси (С, Si, Mn, Ni, Cr, O, P, S и др.), которые по форме существования в железе можно разбить:
- Mn, Ni, Cr и др. Размеры их атомов и железа отличаются не значительно (до 10-15%), такие примеси обладают неограниченной растворимостью в жидком железе и высокой в твердом. Они образуют с железом твердые растворы типа замещения;
- С, N, H. Радиусы их атомов меньше, чем у железа (в 2-4 раза) и они образуют твердые растворы типа внедрения. Углерод с железом, а также с другими металлами дают химические соединения - карбиды, азот – нитриды, водород – гидриды.
- Si, P. В жидком железе их растворимость неограниченна, а в твердом – значительна. С железом образуют довольно прочные соединения: кремний – силициды, фосфор - фосфиды.
- О, S. Оба элемента обладают малой растворимостью в твердом железе (~0,01 % О, ~0,015 % S). В жидком железе кислород растворяется ограниченно (~0,23 % при 1600 0С), а S - значительно. С железом образуют прочные соединения: кислород – оксиды, сера – сульфиды.
Сталь получают из чугуна и лома методом окислительного рафинирования (т. е. очищения). Кислород для окисления содержащихся в них примесей (углерода, кремния, марганца, фосфора и др.) поступает или из атмосферы, или из железной руды и других окислителей, либо при продувке ванны газообразным кислородом. Стадии окислительного рафинирования:
· передача кислорода металлу из окисляющей фазы;
· окислительные реакции;
· удаление из металла продуктов реакции в отдельную фазу.
В современных сталеплавильных процессах главной частью металлической шихты является твердый или жидкий чугун, содержание углерода в котором всегда значительно выше, чем должно быть в готовой стали. В связи с этим сталеплавильные процессы сопровождаются процессом удаления избыточного углерода из металла. Удаление 1 % С из металла связано с образованием газовой фазы, объем которой значительно больше объема жидкой ванны. Выделение из ванны пузырей газа, представляющего продукт окисления углерода, сопровождается интенсивным перемешиванием ее, ускорением процессов тепло- и массообмена, дегазации металла и удаления из него неметаллических включений.
Растворенный углерод в железе условно обозначают [С]. Продуктом реакции окисления углерода в расплаве является преимущественно монооксид углерода СО, хотя при низких концентрациях углерода в металле возможно образование незначительных количеств диоксида углерода СО2. Схематически можно представить реакцию окисления углерода в виде
[С] + [О] = {СО}
(фигурные скобки означают, что продукт реакции входит в самостоятельную газовую фазу). Константу равновесия реакции можно определить из следующего выражения
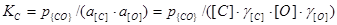 .
.
Для низких концентраций исходных компонентов приближенно считают значения  , равными единице. Тогда при
, равными единице. Тогда при 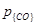 = 1 имеем КC = 1/[С].[О], а так как 1/ КC = const, то произведение [С].[О] при данной температуре постоянно, его обозначают символом m, т.е. [С].[О] = m. Следовательно, от концентрации углерода зависит концентрация кислорода в металле. Чем выше содержание углерода в металле, тем ниже содержание кислорода в нем и наоборот. Однако в реальных условиях реакция равновесие не достигает и фактическое содержание кислорода в металле выше, чем равновесное.
= 1 имеем КC = 1/[С].[О], а так как 1/ КC = const, то произведение [С].[О] при данной температуре постоянно, его обозначают символом m, т.е. [С].[О] = m. Следовательно, от концентрации углерода зависит концентрация кислорода в металле. Чем выше содержание углерода в металле, тем ниже содержание кислорода в нем и наоборот. Однако в реальных условиях реакция равновесие не достигает и фактическое содержание кислорода в металле выше, чем равновесное.
Выделение оксида углерода возможно, если присутствуют условия, облегчающие зарождение пузырей СО. Такими условиями могут быть продувка металла кислородом или воздухом и наличие шероховатости на поверхности огнеупорной футеровки, контактирующей с жидким металлом. В этих случаях имеются готовые газообразные полости в металле с развитой поверхностью раздела газ-металл, в которые беспрепятственно выделяется монооксид углерода СО, как продукт взаимодействия углерода и кислорода вблизи этой поверхности. Выделяющийся пузырь должен преодолеть давление, представляющее собой сумму давлений - атмосферы, столба шлака, столба металла и силы поверхностного натяжения σ расплава, т.е.  , где r - радиус пузыря монооксида углерода.
, где r - радиус пузыря монооксида углерода.
Повышение температуры способствует не только повышению скорости окисления углерода, но и повышает химическое сродство углерода к кислороду.
Снижение внешнего давления (создание разрежения над металлом) в соответствии с принципом Ле-Шателье приводит к смещению равновесия реакции [С] + [О] = {СО} в сторону образования продукта реакции. В равновесных условиях при этом окажется более низкая концентрация кислорода в металле, а углерод становится хорошим раскислителем.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1025; Нарушение авторских прав?; Мы поможем в написании вашей работы!