
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Традиционные названия сложных соединений
|
|
|
|
Гидриды. Большинство гидридов называют, добавляя к корню латинского названия суффикс «-ан»:  – боран,
– боран,  – сульфан; исключение составляют: вода, галогеноводороды, аммиак и остальные гидриды элементов VА группы (при образовании названия последних используется суффикс «-ин», например: фосфин).
– сульфан; исключение составляют: вода, галогеноводороды, аммиак и остальные гидриды элементов VА группы (при образовании названия последних используется суффикс «-ин», например: фосфин).
Если число неводородных атомов превышает единицу, то его указывают числовой приставкой, например:  – дисульфан,
– дисульфан,  – диборан.
– диборан.
Бескислородные кислоты. Водные растворы бинарных соединений водорода с галогенами и халькогенами являются кислотами. Их название включает название элемента с окончанием «о» и слова «водородная»:  [8] – хлороводородная кислота,
[8] – хлороводородная кислота, 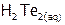 – теллуроводородная кислота. Аналогично строятся названия водных растворов псевдогалогенидов[9] водорода, например, синильную кислоту
– теллуроводородная кислота. Аналогично строятся названия водных растворов псевдогалогенидов[9] водорода, например, синильную кислоту 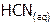 называют циановодородной, родановодородную
называют циановодородной, родановодородную 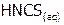 – тиоциановодородной, а
– тиоциановодородной, а  – азидоводородной.
– азидоводородной.
Оксокислоты и их соли. Если элемент образует оксокислоту (т.е. кислородосодержащую) в высшей (или единственной) степени окисления (ст.ок.), то ее название состоит из корня русского названия элемента и частиц: «-ная», «-овая», «-евая». Например: 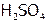 – серная кислота,
– серная кислота, 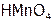 – марганцовая,
– марганцовая, 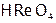 – рениевая кислота.
– рениевая кислота.
Названия кислот, в которых элемент находится не в высшей ст.ок., строятся аналогично, но используются другие суффиксы: «-ист», «-оват», или «‑оватист», в зависимости от возможного числа ст.ок. элемента при образовании им анионов кислот. Примеры названий кислот и их солей даны в табл. 3.
Если элемент в одной и той же ст.ок. образует кислоты, различающиеся по «содержанию воды», то названия кислот (а также их солей) начинаются с префикса: «орто-», «мезо-» или «мета-», – смысл которых ясен из примеров: 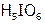 – ортоиодная кислота,
– ортоиодная кислота,  – мезоиодная кислота,
– мезоиодная кислота,  – метаиодная кислота,
– метаиодная кислота, 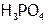 – ортофосфорная кислота,
– ортофосфорная кислота, 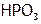 – метафосфорная кислота. Оксокислоты, содержащие два или более центральных атомов, относятся к поликислотам и в их название вводят соответствующую числовую приставку. Например:
– метафосфорная кислота. Оксокислоты, содержащие два или более центральных атомов, относятся к поликислотам и в их название вводят соответствующую числовую приставку. Например:  – дисерная кислота.
– дисерная кислота.
Таблица 3. Традиционные названия оксокислот и их солей
| HMnO4 | Марганцовая кислота | KMnO4 | Перманганат калия |
| H2MnO4 | Марганцеватая кислота | K2MnO4 | Манганат калия |
| H2MnO3 | Марганцовистая кислота | K2MnO3 | Манганит калия |
| H2MnO2 | Марганцеватистая кислота | K2MnO2 | Гипоманганит калия |
| HNO3 | Азотная кислота | KNO3 | Нитрат калия |
| HNO2 | Азотистая кислота | KNO2 | Нитрит калия |
| H2N2O2 | Азотноватистая кислота | K2N2O2 | Гипонитрит калия |
| H3AsO4 | Мышьяковая кислота | Na3AsO4 | Арсенат натрия |
| H3AsO3 | Мышьяковистая кислота | Na3AsO3 | Арсенит натрия |
Если в оксокислоте есть атомы водорода, непосредственно связанные с ц.а. (что можно отразить в формуле, например: 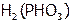 или
или  ), то используют систематические названия (триоксогидридофосфат(III) водорода и диоксодигидридофосфат(I) водорода соответственно), а не традиционные (фосфористая и фосфорноватистая кислоты), которые не отражают особенности кислот данного типа.
), то используют систематические названия (триоксогидридофосфат(III) водорода и диоксодигидридофосфат(I) водорода соответственно), а не традиционные (фосфористая и фосфорноватистая кислоты), которые не отражают особенности кислот данного типа.
Таблица 4. Названия веществ
| Формула вещества | Систематические названия | Традиционное название | |
| с числовыми приставками | по способу Штока | ||
| HNO3 | Триоксонитрат водорода | Нитрат(V) водорода | Азотная кислота |
| HNO4 (т.е. HNO2(О2)) | Пероксодиоксонитрат водорода | Пероксонитрат(V) водорода | Надазотная кислота |
| H4I2O9 | Нанооксодииодат тетраводорода | Ортодииодат(VII) водорода | Ортодииодная Кислота |
| NaH2AsO4 | Тетраоксоарсенат диводорода-натрия | Ортоарсенат(V) водорода-натрия (2:1) | Дигидроортоарсенат натрия |
| NaNiO2 | Диоксоникелат натрия | Метаникелат(III) натрия | Метаникелат натрия |
| Na2SnO2 | Диоксостаннат динатрия | Станнат(II) натрия | Станнит натрия |
| Pb2PbO4 | Тетраоксоплюмбат дисвинца | Ортоплюмбат(IV) cвинца(II) | Ортоплюмбат свинца(II) |
Традиционные названия оснóвных солей (гидроксосолей) образуют, добавляя к наименованию аниона приставку гидроксо-:  – гидроксокарбонат меди(II); а традиционные названия кислых солей образуют, используя приставку «гидро-»:
– гидроксокарбонат меди(II); а традиционные названия кислых солей образуют, используя приставку «гидро-»:  – гидросульфит калия,
– гидросульфит калия,  – дигидродифосфат натрия. Названия некоторых других веществ (систематические и традиционные) – табл. 4.
– дигидродифосфат натрия. Названия некоторых других веществ (систематические и традиционные) – табл. 4.
Классификация неорганических веществ
При изложении правил ИЮПАК, на которых основана современная номенклатура неорганических соединений, использовалась классификация, согласно которой все вещества делятся на простые, бинарные и сложные (в том числе КС).
Простые соединения делятся на металлы и неметаллы, а также на вещества с молекулярной кристаллической решеткой ( ,
, 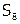 ) и немолекулярной (B, Li) [8].
) и немолекулярной (B, Li) [8].
Бинарные соединения по характеру химической связи разделяются на ионные (NaCl), ковалентные (НСl) и металлоподобные. К последним относятся и интерметаллиды (соединения между металлами, например,  ). Различают также бинарные вещества с молекулярной решеткой (
). Различают также бинарные вещества с молекулярной решеткой ( ) и с немолекулярной (
) и с немолекулярной (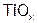 ) [8]. Общепринята классификация бинарных соединений по природе анионообразователя: гидриды, оксиды, хлориды, карбиды и т.д. А, например, оксиды подразделяют на кислотные (
) [8]. Общепринята классификация бинарных соединений по природе анионообразователя: гидриды, оксиды, хлориды, карбиды и т.д. А, например, оксиды подразделяют на кислотные ( ), оснóвные (CaO), амфотерные (ZnO) и индифферентные (NO). (Последние при об.у. не реагируют ни с водой, ни с кислотами, ни со щелочами.)
), оснóвные (CaO), амфотерные (ZnO) и индифферентные (NO). (Последние при об.у. не реагируют ни с водой, ни с кислотами, ни со щелочами.)
Кроме того, соединения с кислородом в зависимости от ст.ок. элемента делятся на низшие (СО, 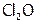 ) и высшие (
) и высшие ( ,
, 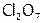 ), а в зависимости от ст.ок. кислорода – на оксиды (
), а в зависимости от ст.ок. кислорода – на оксиды (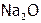 ), пероксиды (
), пероксиды ( ), надпероксиды (
), надпероксиды ( ) и озониды (
) и озониды ( ).
).
Если бинарные соединения можно рассматривать как продукты взаимодействия простых веществ, то сложные (содержащие более двух элементов) как продукты взаимодействия (хотя бы косвенного) бинарных соединений ( ,
,  ) или бинарного вещества с простым (
) или бинарного вещества с простым ( ).
).
Сложныесоединения по характеру связи между структурными элементами разделяют на электролиты (т.е. вещества с достаточно ионной связью между катионом и анионом (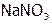 ) или полярноковалентной (НСlO)) и неэлектролиты, в частности, соединения с ковалентной связью (
) или полярноковалентной (НСlO)) и неэлектролиты, в частности, соединения с ковалентной связью ( ) или металлической (
) или металлической (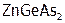 ).
).
Химические вещества можно также классифицировать по функциональному признаку, например: окислители и восстановители, растворители и осадители, кислоты и основания. А кислоты и основания делятся на одно-, двух- (и т.д.) основные и кислотные, соответственно; а также на сильные (HCl, NaOH) и слабые (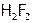 ,
, 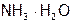 ). Кроме того, кислоты различают: бескислородные (
). Кроме того, кислоты различают: бескислородные ( ), кислородосодержащие (
), кислородосодержащие (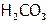 ), комплексные (
), комплексные (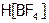 ), а также мономерные (
), а также мономерные (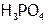 ), димерные (
), димерные ( ), полимерные (
), полимерные (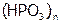 ).
).
Соли тоже подразделяются на кислородосодержащие (Na2SO4), бескислородные (NaF), комплексные ( ), а, кроме того, на средние или нормальные (
), а, кроме того, на средние или нормальные (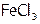 ), кислые (
), кислые ( ), оснóвные (
), оснóвные (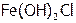 ), а также на простые (
), а также на простые (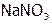 ), двойные (
), двойные (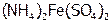 ) и смешанные (
) и смешанные (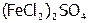 ).
).
Возможна классификация веществ по агрегатному состоянию при обычных условиях (об.у.): твердые (С, ZnO, 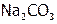 ), жидкие (Hg,
), жидкие (Hg, 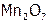 ,
, 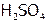 ), газообразные (
), газообразные (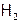 , CO); по растворимости, например, в воде: растворимые (
, CO); по растворимости, например, в воде: растворимые (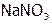 ,
, 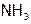 ), среднерастворимые (
), среднерастворимые ( ,
, 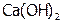 ) и малорастворимые (
) и малорастворимые (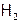 , СuO,
, СuO,  ); и т.д.
); и т.д.
Таким образом, классификацию веществ можно проводить по-разному в зависимости от принципа или признака, которые кладутся в ее основу.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 1931; Нарушение авторских прав?; Мы поможем в написании вашей работы!