
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эластин
|
|
|
|
Эластин – основной белковый компонент, из которого состоят эластические волокна. Он отличается от коллагена по химическому составу и молекулярной структуре.
Общими для эластина и коллагена являются большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине мало метионина и отсутствуют триптофан и цистеин.
В отличие от коллагена в эластине значительно больше валина и ала-нина и меньше глутаминовой кислоты и аргинина. В целом характерной особенностью первичной структуры эластина является слишком малое содержание полярных аминокислотных остатков. При ферментативном гидролизе эластина в гидролизате обнаруживаются десмозин и изодесмо-зин. Эти соединения содержатся только в эластине. Структура их довольно необычна: 4 остатка лизина, соединяясь своими радикалами, образуют замещенное пиридиновое кольцо. Считают, что при образовании десмозина сначала 3 остатка лизина окисляются до соответствующих ε-альдегидов, а затем происходит их соединение с четвертым остатком лизина:
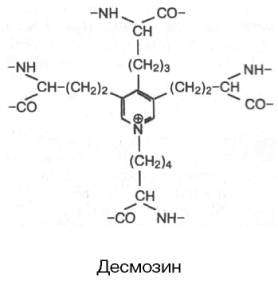
Очевидно, именно благодаря своей структуре десмозин и изодесмозин могут одновременно входить в состав четырех пептидных цепей. По-видимому, этим можно объяснить, что эластин в отличие от других фибриллярных белков способен растягиваться в двух направлениях.
В гидролизатах эластина найдена еще одна необычная «аминокислота», пик которой на хроматограммах располагается между орнитином и лизином. Оказалось, что это лизиннорлейцин, который обеспечивает наряду с десмозином и изодесмозином поперечные связи в молекуле эластина:
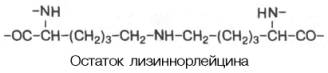
Эластин вместе с коллагеном, протеогликанами и рядом глико- и муко-протеинов является продуктом биосинтетической деятельности фиброблас-тов. Непосредственным продуктом клеточного биосинтеза считается не эластин, а его предшественник – тропоэластин (в коллагене – проколлаген). Тропоэластин не содержит поперечных связей, обладает растворимостью. В последующем тропоэластин превращается в зрелый эластин, нерастворимый, содержащий большое количество поперечных связей.
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!