
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Нарушение механизмов синаптической передачи
|
|
|
|
Нарушение нервной регуляции периферических органов и систем
Важнейшим проявлением действия нейротоксикантов является нарушение механизмов нервной регуляции жизненно важных органов и систем: сердечно-сосудистой, дыхательной, двигательней и др. Эти нарушения прослеживаются при формировании любого острого нейротоксического процесса. Интоксикация конвульсантам, наркотиками, психодислептиками и др. как правило, сопровождается изменением частоты и глубины дыхания, нарушениями сердечного ритма и артериального давления, многочисленными вегетативными реакциями и т.д. Именно эти эффекты и становятся причиной гибели пострадавших при тяжелых отравлениях рассмотренными выше токсикантами (остановка дыхания, сердечной деятельности).
Существуют вещества, в основе действия которых на организм лежит способность "избирательно" нарушать периферические механизмы нервной регуляции органов и систем. К числу таковых относятся токсиканты, не проникающие (или плохо проникающие) через гематоэнцефалический барьер, но влияющие на передачу импульсов с нервной клетки на иннервируемый орган и повреждающие проведение сигнала по возбудимым мембранам нервных волокон, мышечной и железистой ткани.
Все вещества, нарушающие передачу нервных импульсов в холинергических и катехоламинергических синапсах периферического отдела нервной системы, вызывают рассматриваемые эффекты. Свойства большинства этих веществ хорошо известны из курса фармакологии. К числу наиболее токсичных из известных токсикантов относятся некоторые карбаматы (см. выше), нейротоксины, выделенные из яда змей, и ботулотоксин.
Яды змей
Яды змей, относящихся к семейству Elapidae (тигровая змея, тайпан, морские змеи), содержат нейротоксины, избирательно действующие на механизмы передачи нервного импульса в холинэргических нервно-мышечных синапсах (таблица 22).
Таблица 22. Свойства основных нейротоксинов ядов змей
| Токсин | Молекулярная масса | Масса субъединиц | ЛД50 для мышей (мкг/г) |
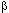 -бунгаротоксин
Кротоксин
Нотексин
Тайпоксин -бунгаротоксин
Кротоксин
Нотексин
Тайпоксин
| 13500+7000 14000+8000 18000+14000+13000 | 0,025 0,05 0,025 0,002 |
(По Howard B.D., 1982)
Все перечисленные в таблице токсины проявляют активность фосфолипаз А2, причем каталитический центр энзимов является функционально значимым для реализации их токсического действия. Интересно отметить, что большинство известных фосфолипаз А2, выделяемых из других источников (поджелудочной железы млекопитающих, пчелиного яда и т.д.), не смотря на высокую специфическую энзиматическую активность, не обладают нейротоксичностью.
Нейротоксические фосфолипазы змеиных ядов угнетают спонтанное и вызванное возбуждением высвобождение ацетилхолина нервными окончаниями мотонейронов, а также некоторыми холинергическими нейронами вегетативной нервной системы. Токсины не проникают через гематоэнцефалический барьер и потому их эффект реализуется лишь на периферии, главным образом в нервно-мышечных синапсах.
Основные клинические признаки отравлений, обусловленные действием нейротоксинов при укусах змей, включают: миальгию при движении, птоз, паралич языкоглоточного нерва, парез конечностей, нарушение сердечной деятеьности, гиперкалиемию, паралич дыхательной мускулатуры.
Блок проведения нервного импульса в нервно-мышечных синапсах развивается в три стадии. В течение первых 5 - 10 минут после воздействия отмечается уменьшение количества ацетилхолина, высвобождаемого при возбуждении нервного волокна. В последующие 30 - 60 минут, при активации нейрона, регистрируется повышенный выброс нейромедиатора. Затем, в течение 60 - 120 минут отмечается постепенное снижение высвобождения ацетилхолина до полного прекращения. В тех случаях, когда в эксперименте используют токсины, фосфолипазная активность которых угнетена химическими модификаторами, удается воспроизвести только первую стадию токсического действия ядов.
Клинически продолжительность латентного периода от момента введения токсина до развития эффекта составляет, как правило, не менее 60 минут. Увеличение дозы вводимого вещества не приводит к уменьшению этого времени. В латентном периоде токсины необратимо связываются с нервными терминалиями. Попытка в условиях эксперимента отмыть токсин от нервных окончаний биопрепарата не приводит к восстановлению способности проводить нервный импульс.
В паралитической стадии интоксикации с помощью электронно-микроскопических исследований удается выявить существенные нарушения структуры пресинаптических отделов холинэргических синапсов. Отмечается набухание митохондрий и их разрушение, значительное уменьшение числа синаптических везикул, уплотнение аксоплазмы.
Механизм действия токсинов до конца не выяснен. Полагают, что нейротоксические фосфолипазы специфически связываются с определенными сайтами пресинаптической мембраны, а затем вызывают неспецифическое разрушение фосфоглицеридов мембраны вокруг сайта, инактивируя тем самым важные в функциональном плане структуры синапса. Опыты, выполненные на изолированных синаптосомах указывают, что одной из таких структур может являться система эффлюкса Са2+ в клетку и клеточные органеллы или каналы для других ионов, в частности К+. Полагают также, что для реализации токсического действия токсины должны попасть внутрь нервных терминалий с помощью механизма специфического эндоцитоза, где и вызывают повреждение синаптосом и митохондрий, нормальная функциональная активность которых необходима для экзоцитоза ацетилхолина. Поскольку нетоксичные фосфолипазы А2 неспецифически связываются с фосфоглицеридами любых, в том числе и несинаптических, биологических мембран, они не обладают свойствами нейротоксикантов.
Различные токсины, вероятно, связываются с различными сайтами пресинаптических структур. Так, одновременная инкубация биопрепарата с двумя нейротоксическими фосфолипазами А2 вызывает блок проведения импульса со значительно большей скоростью, чем с двойной дозой каждого из нейротоксинов в отдельности.
За исключением 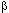 -бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.
-бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.
В настоящее время бунгаротоксин, кротоксин, тайпоксин широко используются в практике лабораторных исследований физиологии и биохимии синапсов.
Ботулотоксин
Ботулотоксин - белок, продуцируемый микроорганизмами Clostridium botulinum. Эти бактерии развиваются в белковой среде (в анаэробных условиях) и порой являются причиной массовых пищевых отравлений, при использовании испорченных консервов, копченостей, грибов и т.д. (ботулизм). Ботулотоксин - табельное отравляющее вещество армии США.
В настоящее время известно более 8 серологических типов токсина: A, B, C, D, E, F и т.д., близких по структуре и токсической активности. Ботулотоксин представляет собой протеины с молекулярной массой 150000, состоящие из двух субъединиц (МВ 100000 и 50000), не обладающие протеолитической, фосфолипазной или иной ферментативной активностью. Токсины выделены в кристаллической форме. В водных растворах частично гидролизуются, но токсичность раствора при этом не теряется. Вещество устойчиво к кипячению в течение часа.
Смертельная доза токсина для человека составляет около 5 нг/кг массы.
Вещество проникает в организм через желудочно-кишечный тракт с зараженной водой и пищей, а при применении его в виде аэрозоля и через органы дыхания.
При исследовании судьбы токсиканта в организме установлено, что он избирательно захватывается нервными терминалиями холинэргических волокон; часть введенного токсина путем ретроградного аксонального тока транспортируется в тела нервных клеток. Об этом свидетельствует, в частности, высокое содержание J125 в ипсилатеральных (но не контралатеральных) полусегментах спинного мозга экспериментальных животных после введения им яда, меченого изотопом.
Клиника ботулизма развивается спустя несколько часов после действия яда (до 36). Первые симптомы интоксикации, это сочетание вегетативных реакций (тошнота, рвота, слюнотечение) и признаков общего недомогания (головная боль, головокружение, боли в конечностях). Позже нарушается функция слюнных и потовых желез, аккомодация органа зрения, расширяются зрачки. Основным проявлением интоксикации является постепенно развивающийся паралич поперечно-полосатой мускулатуры. Процесс начинается с глазодвигательной группы мышц. Ранним признаком отравления является диплопия. Позже присоединяется паралич мышц глотки, пищевода (нарушение глотания) и других мышечных групп. Токсический процесс постепенно нарастает. Иногда лишь на 10 сутки и в более поздние сроки может наступить смерть от паралича дыхательной мускулатуры и асфиксии. Летальность при отравлении ботулотоксином составляет от 15 до 30%, а при несвоевременном оказании помощи (введение антиботулинической сыворотки, перевод пострадавшего на искусственную вентиляцию легких и т.д.) может достигать 90%.
Ботулотоксин избирательно блокирует высвобождение ацетилхолина в нервно-мышечных синапсах. В опытах in vitro установлено, что действие ботулотоксина приводит к угнетению как спонтанного, так и вызванного выброса нейромедиатора. Чувствительность постсинаптического рецептора к ацетилхолину не изменяется. Блокада передачи сигнала не сопровождается вмешательством токсиканта в процессы синтеза и хранения ацетилхолина. При исследованиях in vitro спонтанная и индуцируемая активность концевой пластинки нейрона снижается на 90% в течение 60 - 90 минут, после добавления в инкубационную среду токсина в концентрации 10-8 М. По расчетам, для блокады синапса достаточно 10 молекул токсина. Чем выше нервная активность, тем быстрее происходит развитие интоксикации. Морфологические изменения в пораженных синапсах не выявляются методами световой и электронной микроскопии.
Действие вещества продолжительно, до нескольких недель, и потому характер взаимодействия токсина с пресинаптическими структурами-мишенями можно рассматривать как необратимое. Полагают, что восстановление нормальной иннервации мышц происходит в результате формирования новых синаптических контактов.
Периоду клинических проявлений предшествует скрытый период, во время которого и происходит связывание токсиканта с нервными окончаниями. Выделяют четыре периода действия токсина на синапс:
- связывание с плазматической мембраной холинергических нервных окончаний;
- интернализации токсина путем эндоцитоза;
- проникновение в цитозоль синапса при участии pH-зависимой транслоказы;
- внутриклеточное расщепление токсина под влиянием метал-зависимых эндопротеаз с высвобождением действующей части белковой молекулы. Для некоторых серотипов токсина эти молекулы идентифицированы и обозначены как: SNAP-25 (серотип А), синаптобревин (серотип В), синтаксин (серотип С).
Молекулярный механизм действия токсина до настоящего времени не выяснен. Вероятно, в основе эффекта лежит нарушение токсином механизма взаимодействия синаптических везикул, в которых депонирован ацетилхолин, с аксолемой, - необходимый этап процесса Ca2+-зависимого экзоцитоза медиатора. Электрофизиологические исследования показывают, что в отличии от нормальной реакции нервно-мышечного синапса на повышение содержания кальция в инкубационной среде (дозо-зависимый выброс нейромедиатора), увеличение концентрации экстрацеллюлярного кальция с 2 до 16 мМ не приводит к усилению выброса ацетилхолина волокном, обработанным ботулотоксином. Совместное введение в инкубат Ca2+ (4 мМ и выше) и ионофора усиливает выброс ацетилхолина из нервных окончаний обработанных токсином.
Как in vitro, так и in vivo нервную передачу в синапсах временно нормализует 4-аминопиридин. При введении летальной дозы токсина экспериментальному животному, последующее назначение 4-аминопиридина отчасти восстанавливает двигательную активность животного на 1 - 2 часа. К сожалению, из-за высокой токсичности и кратковременности эффекта, 4-аминопиридин не может рассматриваться как эффективное противоядие.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 706; Нарушение авторских прав?; Мы поможем в написании вашей работы!