
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия
|
|
|
|
Под внутренней энергией системы понимают полную суммарную энергию всех её структурных элементов.
Внутренняя энергия идеального газа складывается только из кинетических энергий молекул, так как потенциальной энергией их взаимодействия можно пренебречь.
Внутренняя энергия идеального газа U для любого количества молей n может быть определена через среднюю кинетическую энергию, определяемую формулой (9-3). Так как средняя кинетическая энергия идеального газа зависит только от температуры и числа степеней свободы молекулы, то и внутренняя энергия идеального газа также зависит от температуры и числа степеней свободы молекулы:
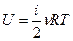 (9-4)
(9-4)
Изменение внутренней энергии идеального газа определяется только изменением температуры и не зависит ни от давления, ни от объёма:
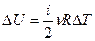 (9-5)
(9-5)
Изменить внутреннюю энергию газа можно, например, совершив над ним работу. Но независимо от того, каким способом совершают работу, изменение внутренней энергии идеального газа зависит только от изменения температуры. Другими словами, изменение внутренней энергии зависит только от параметров начального и конечного состояния, а именно от температуры начального Т1 и конечного состояния Т 2, и не зависит от процесса перехода из начального в конечное состояние. Поэтому внутренняя энергия – функция состояния. Если газ вернули в первоначальное состояние, то изменение внутренней энергии равно нулю.
Для элементарного процесса 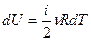 . Можно внести постоянные ν и R под знак дифференциала
. Можно внести постоянные ν и R под знак дифференциала 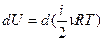 . Таким образом, изменение внутренней энергии является полным дифференциалом величины, стоящей в скобках, и этот факт может служить признаком функции состояния.
. Таким образом, изменение внутренней энергии является полным дифференциалом величины, стоящей в скобках, и этот факт может служить признаком функции состояния.
 9.3. Работа газа при его расширении
9.3. Работа газа при его расширении
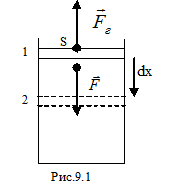
Рассмотрим сжатие идеального газа, находящегося под поршнем (рис.9.1). Под действием внешней силы 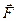 переместим поршень на бесконечно малую величину
переместим поршень на бесконечно малую величину 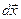 , настолько малую, что будем считать силу
, настолько малую, что будем считать силу 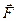 постоянной. Назовём работу постоянной силы по перемещению поршня на бесконечно малую величину элементарной работой и обозначим
постоянной. Назовём работу постоянной силы по перемещению поршня на бесконечно малую величину элементарной работой и обозначим 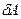 .
. 
 Элементарная работа может быть определена как работа постоянной силы через скалярное произведение силы на перемещение:
Элементарная работа может быть определена как работа постоянной силы через скалярное произведение силы на перемещение:
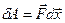 (9-6)
(9-6)
Поскольку направление силы и перемещения совпадают, то 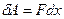 . Газ, находящийся под поршнем, препятствует сжатию и давит на поршень силой
. Газ, находящийся под поршнем, препятствует сжатию и давит на поршень силой 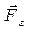 , равной по величине, противоположной по направлению и приложенной к поршню (рис.4.1). Элементарная работа самого газа
, равной по величине, противоположной по направлению и приложенной к поршню (рис.4.1). Элементарная работа самого газа 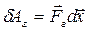 . Так как сила
. Так как сила 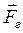 и перемещение
и перемещение 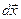 направлены в противоположные стороны, работа самого газа при равномерном сжатии отрицательна и равна по величине работе внешней силы, сжимающей газ
направлены в противоположные стороны, работа самого газа при равномерном сжатии отрицательна и равна по величине работе внешней силы, сжимающей газ 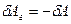 . Сила, действующая на единицу площади поверхности поршня S со стороны газа, есть давление газа Р. Поэтому можно выразить величину силы
. Сила, действующая на единицу площади поверхности поршня S со стороны газа, есть давление газа Р. Поэтому можно выразить величину силы  через давление:
через давление: 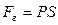 . Тогда элементарная работа газа будет равна:
. Тогда элементарная работа газа будет равна: 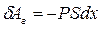 . Но
. Но  есть величина приращения объёма газа. Тогда элементарная работа газа равна:
есть величина приращения объёма газа. Тогда элементарная работа газа равна:
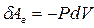 , (9-7)
, (9-7)
а работа внешней силы по сжатию газа равна 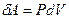 .
.
Для определения работы по перемещению поршня на значительную величину 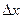 , в результате которой объём газа изменяется на
, в результате которой объём газа изменяется на 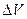 , нужно учесть процесс, происходящий с газом. Работу в этом случае определяют через интеграл:
, нужно учесть процесс, происходящий с газом. Работу в этом случае определяют через интеграл:
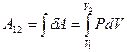 (9-8)
(9-8)
Работа газа (или над газом) зависит от процесса (т.е. от последовательности промежуточных состояний) и поэтому является функцией процесса. Работа не является полным дифференциалом, отсюда и обозначение элементарной работы 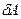 , а не dA.
, а не dA.
 Рассмотрим работу, совершаемую газом, при различных процессах. Будем обозначать в дальнейшем элементарную работу газа просто через
Рассмотрим работу, совершаемую газом, при различных процессах. Будем обозначать в дальнейшем элементарную работу газа просто через 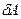 и считать её положительной, если газ расширяется (
и считать её положительной, если газ расширяется (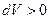 ), и отрицательной, если газ сжимают (
), и отрицательной, если газ сжимают (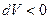 ).
).
Рассмотрим изохорический процесс. При изохорическом процессе объём газа не изменяется, приращение объёма равно нулю, следовательно, работа газа равна нулю.
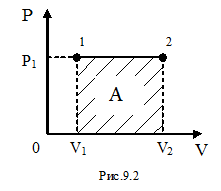
Поскольку работу в любом случае можно определить, пользуясь формулой (9-8), для математической интерпретации работы удобно изображать любой процесс на диаграмме (P,V). Работа на такой диаграмме равна площади фигуры под кривой, изображающей тот или иной процесс, происходящий с газом.
Рассмотрим изобарический процесс (рис. 9.2). Используя формулу (9-8) найдём работу газа при переходе из состояния 1 в состояние 2: 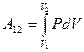 .
.
Так как для данного количества вещества давление остаётся постоянным при изобарическом процессе, то его можно вынести за знак интеграла, тогда получим:
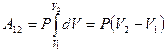 . Обозначим
. Обозначим 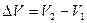 . С учётом этой записи работа при изобарическом процессе определяется по формуле:
. С учётом этой записи работа при изобарическом процессе определяется по формуле:
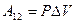 (9-9)
(9-9)
Используя рис.9.2, можно записать работу через указанные параметры состояния: 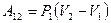 . Такую же формулу мы получим, находя площадь заштрихованного прямоугольника. Часто бывает удобно выражать работу через изменение температуры. Для этого нужно использовать уравнение состояния идеального газа (уравнение Менделеева – Клапейрона) для 1 и 2 состояний:
. Такую же формулу мы получим, находя площадь заштрихованного прямоугольника. Часто бывает удобно выражать работу через изменение температуры. Для этого нужно использовать уравнение состояния идеального газа (уравнение Менделеева – Клапейрона) для 1 и 2 состояний: 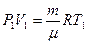 и
и 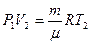 . Вычитая из второго уравнения первое, получим:
. Вычитая из второго уравнения первое, получим:
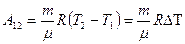 (9-10)
(9-10)
При изобарическом сжатии конечный объём меньше начального и работа газа отрицательна, то есть газ препятствует сжатию.
Формула (9-7) позволяет выразить физический смысл молярной постоянной R. Для одного моля вещества (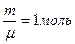 ) работа определяется как
) работа определяется как 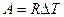 . Отсюда ясен физический смысл R, которая определяется работой изобарического расширения одного моля идеального газа при изменении температуры на один кельвин.
. Отсюда ясен физический смысл R, которая определяется работой изобарического расширения одного моля идеального газа при изменении температуры на один кельвин.
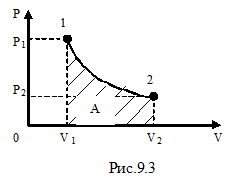 Рассмотрим изотермический процесс (рис.9.3). При изотермическом процессе температура остаётся постоянной, а давление и объём связаны между собой обратно пропорциональной зависимостью. В этом случае, используя формулу (9-8) для определения работы, уже нельзя вынести давление за знак интеграла. Давление выразим из уравнения Менделеева – Клапейрона:
Рассмотрим изотермический процесс (рис.9.3). При изотермическом процессе температура остаётся постоянной, а давление и объём связаны между собой обратно пропорциональной зависимостью. В этом случае, используя формулу (9-8) для определения работы, уже нельзя вынести давление за знак интеграла. Давление выразим из уравнения Менделеева – Клапейрона: 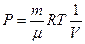 . Подставим правую часть этого уравнения в (9-8) и вынесен за знак интеграла все постоянные:
. Подставим правую часть этого уравнения в (9-8) и вынесен за знак интеграла все постоянные:
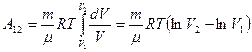 . Учитывая, что разность логарифмов есть логарифм отношения, получим:
. Учитывая, что разность логарифмов есть логарифм отношения, получим:
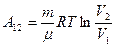 (9-11)
(9-11)
Используя закон Бойля- Мариотта: 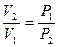 , можем выразить работу и через отношение давлений:
, можем выразить работу и через отношение давлений:
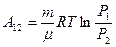 (9-12)
(9-12)
Рассмотренные примеры подтверждают, что работа является функцией процесса.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 782; Нарушение авторских прав?; Мы поможем в написании вашей работы!