
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы, уравнение Ван-дер-Ваальса
|
|
|
|
Лекция №10
Реальные газы, жидкости и твердые тела. Реальные газы, уравнение Ван-дер-Ваальса. Жидкости и их свойства. Основные характеристики и закономерности агрегатных состояний и фазовых переходов. Поверхностное натяжение. Капиллярные явления. Твердые тела.
Состояние реального газа нельзя описать с помощью уравнения Менделеева – Клапейрона, справедливого только для идеальных газов. Однако, если ввести в это уравнение поправки на силы взаимодействия между молекулами и собственный объём молекул, то можно получить уравнение, описывающее состояние реального газа. Такое уравнение было предложено Ван-дер-Ваальсом в 1873 году. Рассмотрим схему получения уравнения Ван-дер-Ваальса из уравнения Менделеева - Клапейрона для одного моля молекул газа 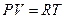 . Для перехода к уравнению состояния реального газа нужно учесть силы отталкивания, а, следовательно, собственный объём молекул. Для этого вводится поправка на молярный объём (или силы отталкивания) b. В СИ b измеряется в
. Для перехода к уравнению состояния реального газа нужно учесть силы отталкивания, а, следовательно, собственный объём молекул. Для этого вводится поправка на молярный объём (или силы отталкивания) b. В СИ b измеряется в 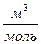 . Тогда получим уравнение состояния одного моля газа, учитывающее силы отталкивания между молекулами в виде:
. Тогда получим уравнение состояния одного моля газа, учитывающее силы отталкивания между молекулами в виде: 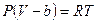 . Отсюда
. Отсюда  . Если увеличивать давление, то при
. Если увеличивать давление, то при 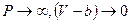 , следовательно, V=b. Отсюда виден физический смысл поправки b, заключающийся в том, что поправка на объём численно равна предельному объёму, который бы занял 1 моль реального газа при бесконечно большом давлении. Детальное рассмотрение даёт
, следовательно, V=b. Отсюда виден физический смысл поправки b, заключающийся в том, что поправка на объём численно равна предельному объёму, который бы занял 1 моль реального газа при бесконечно большом давлении. Детальное рассмотрение даёт 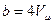 , то есть поправка на объём равна учетверённому объёму 1 моля молекул газа. Объём одной молекулы, считая её сферической, равен:
, то есть поправка на объём равна учетверённому объёму 1 моля молекул газа. Объём одной молекулы, считая её сферической, равен: 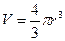 . Молярный объём
. Молярный объём 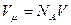 . Тогда поправка на объём выражена формулой:
. Тогда поправка на объём выражена формулой:
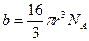 (10-1)
(10-1)
Учтём силы притяжения между молекулами газа, которые вызывают уменьшение давления на стенки сосуда на величину Pi, которую называют внутренним давлением газа. Молекулы, находящиеся в поверхностном слое газа (их число обратно пропорционально объёму), притягиваются ближайшими молекулами внутри газа (их число тоже обратно пропорционально объёму), следовательно, P i ~ n2 , а значит, P i ~ V – 2 . Можно записать равенство:
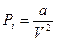 (10-2)
(10-2)
Здесь a – поправка на давление или силы притяжения, она различна для разных газов и в СИ измеряется в 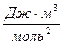 . Поправки a и b различны для разных газов. Учитывая обе поправки, получим:
. Поправки a и b различны для разных газов. Учитывая обе поправки, получим: 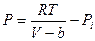 или
или 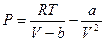 . Это уравнение описывает состояние реального газа. Однако, чаще всего, его записывают аналогично уравнению состояния идеальных газов, тогда уравнение состояние реальных газов для одного моля молекул имеет вид:
. Это уравнение описывает состояние реального газа. Однако, чаще всего, его записывают аналогично уравнению состояния идеальных газов, тогда уравнение состояние реальных газов для одного моля молекул имеет вид:
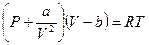 (10-3)
(10-3)
Уравнение состояния реального газа – уравнение Ван-дер-Ваальса - для любого количества вещества будет иметь вид:
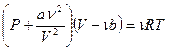 (10-4)
(10-4)
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 462; Нарушение авторских прав?; Мы поможем в написании вашей работы!