
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Препараты простых эфиров
|
|
|
|
1. образование оксониевых солей с концентрированными минеральными кислотами:
R-O-R + HCl à [R-O+-R]Cl-
2. расщепляются в жестких условиях:
R-O-R + HI = R-I + ROH или R-O-R 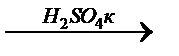 ROSO3H + ROH
ROSO3H + ROH
3. окисляются с образованием перекисных соединений:
R-O-R 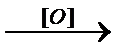 R-O-O-R
R-O-O-R
Титрование в неводных средах как метод количественного определения:
Достоинства титрования в неводных средах:
1. Можно определять органические и неорганические вещества, смеси различных компонентов, которые при титровании в водной среде не дают четкой КТТ (очень слабые кислоты и основания).
2. Можно титровать соединения, которые нерастворимы в воде, разлагаются водой, образуют эмульсии.
3. Можно использовать для бесцветных растворов.
4. КТТ можно определят индикатором, потенциометрически, кондуктометрически.
5. Можно титровать смеси без разделения.
6. Повышается точность титрования. Меньше поверхностное натяжение, меньше размер капли, меньше погрешность.
Недостатки:
1. Необходимо тщательно обезвоживать все растворы, титранты.
Титрование органических оснований и их солей в неводных средах:
Титрант: HClO4
Растворитель: CH3COOH ледяная.
Индикатор: кристаллический фиолетовый. Гексаметилпарарозанилинил хлорид. Три-(п-диметиламинофенил) карбоний хлорид. В щелочной среде фиолетовый, в кислой – желтый.

1. Растворение титранта. Образуется положительно заряженный ион "лиония" – ацетоний = ацелоний.
HClO4 + CH3COOH «ClO4- + CH3COOH2+
2. Растворение слабого основания в неводном растворителе. Образуется отрицательно заряженный ион "лиат" – ацетат.
R3N + CH3COOH «R3N+H + CH3COO-
3. Нейтрализация лиония и лиата. Суть процесса, единственная необратимая реакция.
CH3COO- + CH3COOH2+ à 2CH3COOH
4.
ClO 4 - + R3N+H à [R3N+H]ClO4-
Часто при титровании в ледяной уксусной кислоте добавляют уксусный ангидрид:


Роль уксусного ангидрида:
1. Связывает воду
2. Усиливает основные свойства слабых оснований (в большей мере, чем уксусная кислота). Смотри кофеин.
3. Ацилирует амино-, гидразино-группы, защищяя их при титровании. Смотри изониазид.
4. Способен связывать галогенид-ионы при титровании солей оснований в неводных средах.
Титрование солей:
R3N•HA + CH3COOH «R3NH+ + CH3COO- + HA
(R3N)2H2SO4 + CH3COOH «R3NH+ + CH3COO- + (R3NH+)HSO4-
Для солей серной, фосфорной, азотной кислот никаких особенностей больше нет. Они титруются по первой ступени, фактор равен единице.
А если мы имеем дело с солями галоген-водородных кислот, то возникают сложности. Выделяющаяся кислота может повлиять титрование.
HHal «H+ + Hal-
Cl- + CH3COOH «HCl + CH3COO-
И получится, что титрование идет не количественно. Поэтому надо связать все анионы галогенидов. Используют уксусный ангидрид:
R3N•HHal + (CH3CO)2O «R3NH+ + CH3COO- + CH3COCl
Препараты:
Aether medicinalis. Эфир медицинский. C2H5-O-C2H5
Описание: бесцветная прозрачная подвижная летучая легковоспламеняющаяся жидкость со своеобразным запахом.
Растворимость: растворим в воде, неограниченно в спирте, бензоле, эф. и ж. маслах
Получение:
C2H5OH + H2SO4 à C2H5OSO3H + H2O
C2H5OSO3H + C2H5OH à C2H5-O-C2H5 + H2SO4
Подлинность: Ткип и плотность
Примеси:
Пероксиды
C2H5-O-O-C2H5 + 2KI + H2O à I2 + C2H5-O-C2H5 + 2KOH
Альдегиды (темно-бурый осадок).
CH3CHO + 3KOH + K2HgI4 à комплекс ртути + CH3COOK + 4KI + 2H2O
Применение: растворитель для настоек, экстрактов, в фармацевтическом анализе.
Хранение: в хорошо укупоренной таре склянках оранжевого стекла без света вдали от огня. Закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой.
|
|
|
|
|
Дата добавления: 2014-12-10; Просмотров: 509; Нарушение авторских прав?; Мы поможем в написании вашей работы!