
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Размер, состав и заряд атомного ядра. Массовое и зарядовое числа
|
|
|
|
Модели атома Томпсона и Резерфорда.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Томсону. Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов Резерфорда по рассеянию α -частиц в веществе. На основании своих исследований Резерфорд предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе (Z - порядковый номер элемента в системе Менделеева, е - элементарный заряд), размер 10-15-10-14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10–10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и, в конце концов, упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным.
Размер атомного ядра очень мал (10-12—10-13 см), что приблизительно в 105 раз меньше диаметра всего атома.
Атомное ядро состоит из элементарных частиц -протонов и нейтронов. Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя тр = 1,6726×10–27кг ≈ 1836 тe, где тe - масса электрона. Нейтрон (n) - нейтральная частица с массой покоя тп = 1,6749× 10–27кг ≈ 1839 тe.
Протоны и нейтроны называются нуклонами. Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Ze (Z - зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в Периодической системе элементов Менделеева, е - элементарный заряд).
Постулаты Бора.
I. Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1 , Е2 ... En. Находясь в стационарном состоянии, атом энергии не излучает, несмотря на движение электронов.
II. В стационарном состоянии атома электроны движутся по стационарным орбитам, для которых выполняется квантовое соотношение:
m·V·r = n·h/2·p
m·V·r = L - момент импульса
h - постоянная Планка
n = 1,2,3...
III. Излучение или поглощение энергии атомом происходит при переходе его из одного стационарного состояния в другое. При этом излучается или поглощается порция энергии (квант), равная разности энергий стационарных состояний, между которыми происходит переход:
e = h · v = Em-En
Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там явлений. Выводы, основанные на постулатах Бора, объясняют закономерности в спектре атома водорода, происхождение характеристических спектров рентгеновских лучей и т.д.
Спектр - совокупность различных значений, которые может принимать данная физическая величина.
Спектр и энергетические уровни атома водорода были впервые истолкованы с помощью постулатов Бора.
Первый постулат Бора (постулат стационарных состояний):
В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым электроны движутся с ускорением, но излучения света при этом не происходит.
Правило квантования орбит: в стационарном состоянии атома электрон, движущийся по круговой орбите, имеет квантованные значения момента импульса, удовлетворяющие условию:
Lk = mvr = kћ
m - масса электрона
v - скорость электрона
r - радиус k-й орбиты
ћ = h/2π
Втором постулат Бора (правило частот):
При переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией равной разности энергий соответствующих стационарных состояний.
hv = En - Em
Еn и Em - энергии стационарных состояний атома до и после излучения
Спектр излучения атомарного водорода состоит из отдельных спектральных линий, которые располагаются в определенном порядке. Бальмер установил, что длины волн (или частоты) этих линий могут быть представлены формулой

R = 2,07× 1016 с -1 - постоянная Ридберга
 Учитывая, что 1/λ = v/с = w/2pс и используя предыдущую формулу, найдем
Учитывая, что 1/λ = v/с = w/2pс и используя предыдущую формулу, найдем
R =1,0974×107 м-1 - также называется постоянной Ридберга
На рисунке изображена схема энергетических уровней атома водорода при z = 1
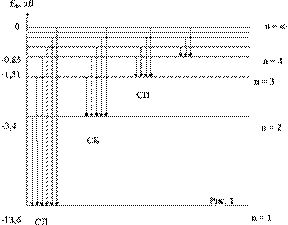
При переходе электрона с более высоких энергетических уровней на уровень n = 1 возникает ультрафиолетовое излучение или излучение серии Лаймана (СЛ).
Когда электроны переходят на уровень n = 2 возникает видимое излучение или излучение серии Бальмера (СБ).
При переходе электронов с более высоких уровней на уровень n = 3 возникает инфракрасное излучение, или излучение серии Пашена (СП) и т.д.
Частоты или длины волн, возникающего при этом излучения, определяются по предыдущим двум формулам (с постоянной Ридберга) при m = 1 - для серии Лаймана, при m = 2 - для серии Бальмера и при m = 3 - для серии Пашена.
Энергия фотонов определяется по формуле, которую, для водородоподобных атомов, можно привести к виду:

Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития были сделаны важные открытия. Однако в теории Бора обнаружились существенные недостатки, например, с ее помощью невозможно создать теорию более сложных, чем атом водорода, атомов. Поэтому становилось очевидным, что теория Бора представляет собой переходной этап на пути создания последовательной теории атомных и ядерных явлений. Такой последовательной теорией явилась квантовая (волновая) механика.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1735; Нарушение авторских прав?; Мы поможем в написании вашей работы!