
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия движения молекул идеального газа. Основное уравнение МКТ идеального газа
|
|
|
|
Основное уравнение МКТ идеального газа
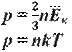 Также его можно записать как
Также его можно записать как
p - давление
n - концентрация газа
v - средняя скорость молекул
T - абсолютная температура газа (to + 273)
Eк - средняя кинетическая энергия молекул газа
k = 1,38 * 10-23 постоянная Больцмана
Абсолютная температура - это безусловная мера температуры и одна из главных характеристик термодинамики. Понятие абсолютной температуры было введено У. Томсоном.
Термодинамическая температура - физическая величина, характеризующая интенсивность хаотического, теплового движения всей совокупности частиц системы и пропорциональная средней кинетической энергии поступательного движения одной частицы.
Абсолютная шкала температуры называется так, потому что мерой основного состояния нижнего предела температуры является абсолютный ноль - наиболее низкая возможная температура, при которой ничего не может быть холоднее и теоретически невозможно извлечь из вещества тепловую энергию. Абсолютный ноль определен как 0 K. Что приблизительно равно −273.15 °C.
Ek = 1 / 2m . v 2 Связь между кинетической энергией, массой и скоростью
Таким образом, частицы одинаковой массы и имеющие одинаковую скорость имеют и одинаковую температуру.
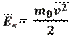
Средняя кинетическая энергия молекул идеального газа
m0 - масса молекулы
v - средняя скорость движения молекул
Число степеней свободы - количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z).
Жесткой связью называется связь, при которой расстояние между атомами не изменяется.
Поступательные степени свободы связаны с движением молекулы как целого в пространстве, вращательные - с поворотом молекулы как целого.
Молекулы, которые состоят из обычного атома, считаются материальными точками и имеют три степени свободы (аргон, гелий).
Двухатомные жесткие молекулы, например молекулы водорода, азота и др., обладают пятью степенями свободы: они имеют 3 степени свободы поступательного движения (по осям x, y, z) и 2 степени свободы вращения вокруг осей ОХ и OZ. Вращением вокруг оси OY можно пренебречь, т.к. момент инерции ее относительно этой оси пренебрежимо мал.
Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой, имеют число степеней свободы i = 6.
Если связь между атомами не жесткая, то добавляются колебательные степени свободы.
Закон равномерного распределения энергии по степеням свободы: статистически в среднем на каждую степень свободы молекул приходится одинаковая энергия. Поступательное движение молекул характеризуется средней кинетической энергией, равной (1).
Так как поступательному движению соответствует 3 степени свободы, то в среднем на одну степень свободы движения молекул приходится энергия равная (2)
В однородном газе, молекулы которого имеют любое число степеней свободы i, каждая молекула в среднем обладает энергией движения, равной (3)

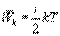
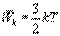
(1) (2) (3) Средняя кинетическая энергия
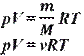 Уравнение Менделеева - Клапейрона, уравнение состояния идеального газа, устанавливающее связь между его объемом V, давлением р и абс. температурой Т.
Уравнение Менделеева - Клапейрона, уравнение состояния идеального газа, устанавливающее связь между его объемом V, давлением р и абс. температурой Т.
Уравнение Менделеева-Клайперона
p - давление газа
V - объем газа
m - масса газа
T - температура газа
M - молярная масса
ν - количество вещества
R = 8,31 - газовая постоянная
Уравнение приближенно выполняется для реальных газов при достаточно низких давлениях; с повышением температуры область давлений, при которых состояние реального газа можно описывать уравнением, расширяется.
Для молекулярных газов (напр., атм. воздуха) при обычных температурах и давлениях до 1,01.105 Па (1 атм) уравнение выполняется достаточно точно. Его широко используют при расчетах термодинамических свойств газов.
Ассоциированные газы не подчиняются уравнению даже при очень низких давлениях.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!