
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Берілген концентрация бойынша ерітінді дайындау 1 страница
|
|
|
|
. 
Жұмыстың мақсаты
Химиялық ыдыстармен жұмыс істеуге үйрету және құрғақ тұздардан берілген концентрацияда ерітінді дайындау біліктілігін қалыптастыру
Жұмыстың мазмұны
Концентрациясы әртүрлі ерітінділер дайындау.
Қаупсіздік ережесі
Жұмысты жасау кезінде химиялық реактивтерді ұқыпты қолдану, реактивтердің зертханалық столға және кйімге төгілмеуін қадағалау керек.
Теориялықнегізі
Ерітінділер дегеніміз – екі немесе одан да көп компонентерден тұратын, құрамы өзгермелі гомогенді(біртекті) жүйе.
Ерітінділердің маңызды түрі – сұйық ерітінділер.
Ерітінділер еріген заттан және еріткіштен тұрады. Ерітінді құрамы еріген затпен еріткіш мөлшерімен анықталады. Ерітінді концентрациясын сипаттау үшін жиі қолданатын бірнеше әдістер бар.
1)Еріген заттың массалық үлесі w(В) дегеніміз еріген заттың массасының m(B) ерітінді массасына mжалпы қатынасы:
w (В) = m(В)/mжалпы немесе w (В) = 100×m(В)/mжалпы (%);
2) Молярлық концентрация с(В) дегеніміз 1 л ерітіндідегі еріген заттың мөлшері:
с(В) = n(В)/Vер-ді, (моль/л);
қолданбалы химия кафедрасы
3) Моляльдік концентрация дегеніміз 1 кг еріткіштегі еріген заттың мөлшері:
b(В) = n(В)/mер-ш, (моль/кг);
4) Нормальдік концентрация дегеніміз 1 л ерітіндідегі еріген заттың эквиваленттік зат мөлшері: 
с(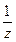 В) = n(
В) = n(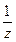 В)/Vерітінді, (моль/л);
В)/Vерітінді, (моль/л);
мұндағы, n(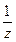 В)-эквиваленттік зат мөлшері.
В)-эквиваленттік зат мөлшері.
5) Титр дегеніміз 1 мл ерітіндідегі еріген заттың грамы:
 , (г/мл)
, (г/мл)
Қажетті қондырғылар мен реактивтер:
а) аналитикалық таразы;
|
|
|
б) ұнтақтағыш фарфор ыдыс;
в) өлшеуіш колба 200 мл.
г) 100 және 300 мл стақандар
д) ерітінділер құюға арналған шыны ыдыс;
е) 25, 50 мл мензуркалар;
ж) натрий хлориді;
з) дистилденген су.
Жұмыстың жүру барысы
1. Берілген концентациядағы тұздың массасын есептеу.
Мысалы: 10 % 200 г натрий сульфатының ерітіндісін дайындау үшін:
100 г ерітіндіде 10 г Na2SO4
200 г ерітіндіде m г Na2SO4
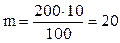 г. Судың массасы 200 - 20 = 180 г.
г. Судың массасы 200 - 20 = 180 г.
Таразыда 10 г Na2SO4 өлшеп, 200 мл колбаға салып, белгі қойылған жерге дейін суды араластыра отырып, құйыңдар.
Кестеден 10 % Na2SO4 ерітіндісінің тығыздығын табамыз:
ол 1,091 г/см3 тең. Ерітіндінің массасы: m = V× p = 1000 × 1,091 = 1091 г
100 г ерітіндіде 10 г Na2SO4
1091 г ерітіндіде m г Na2SO4
қолданбалы химия кафедрасы
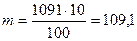 г.
г. 
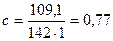 моль/л
моль/л
Осы сияқты басқа концентрацияларды есептеңіздер.
Бақылау сұрақтары;
1. 1 л ерітіндіде 10,6 г натрий карбонаты бар. Осы ерітіндінің молярлық, нормальдық, моляльдік концентрацияларын есептеңіздер.
2. Калий гидроксидінің ерітіндісін дайындау үшін 5,6 г КОН 500 г суға ерітілді. Моляльдік концентрациясы мен мольдік үлесін есептеңіздер.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 6 зертханалық жұмыс
Электролиттiк диссоциация және иондық процестер
Жұмыстың мақсаты
Әлсiз және күштi электролиттердiң қасиетiн зерттеп, олардың алу жолдарымен танысу және иондық теңдiктi жазып үйрену.
Жұмыстың мазмұны
1. Ерітiндiлердiң электрөткiзгiштiгi.
2. Иондық процестер.
3. Қышқыл мен негiздердiң химиялық белсенділіктерін салыстыру.
Жұмыстың теориялық негізі
Электролиттер - сулы ерiтiндiде және балқымаларда ионға диссоциацияланатын заттар. Әлсiз электролиттер қайтымды тепе-теңдiк түзеп өте аз иондарға диссоциацияланады. Күшті электролиттер иондарға толық ыдырайды. Электролиттік сандық сипаттамасын алу үшін диссоциация дәрежесі ұғымы енгізіледі:
|
|
|
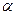 =сд/с
=сд/с
Мұндағы, 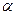 - диссоциациялану дәрежесі, сд - диссоциацияға ұшыраған молекуланың концентрациясы, с - ерітіндінің бастапқы концентрациясы. Әлсіз электролиттердің диссоциациясы қайтымды процесс. Мысалы:
- диссоциациялану дәрежесі, сд - диссоциацияға ұшыраған молекуланың концентрациясы, с - ерітіндінің бастапқы концентрациясы. Әлсіз электролиттердің диссоциациясы қайтымды процесс. Мысалы:
СН3СООН  СН3СОО- + Н+
СН3СОО- + Н+
Диссоциациялану константасы (Кд) әлсiз қышқылдың, негіздің, ал ерігіштік көбейтіндісі (ЕК) нашар еритiн тұздар мен гидроксидтердiң сипаттамалары болып келеді. (Кд және ЕК-нiң мәндерi кестелерде берiлген).
қолданбалы химия кафедрасы
Қолданылатын реактивтер мен аспаптар
1. Стакандар - 7, көмiр стержендерi мен шам, электрошнур мен вилка.
2. Қант, сірке қышқылы, азот қышқылы, аммоний гидроксидi, натрий гидроксидi, калий нитраты ерітiндiлерi және дистилденген су.
3. Темiр(III), мыс, аммоний тұздарының, натрий силикатының, аммоний молибдатының, натрий карбонатының, натрий ацетатының, калий иодидiнің, кальций карбонатының ерiтiндiлерi.
Жұмыстың барысы
1-тәжiрибе. Ерiтiндiлердiң электрөткізгіштігі
Ерiтiндiлердiң электрөткізгіштігін білу үшiн қышқылдардың, тұздардың және гидроксидтердiң судағы ерітінділері алынады. Көлемi 100 мл 7-стаканға 20-30 мл ден кестеде көрсетiлген ертiндiлердi құйып алады да көмiр электродтар батырылады, электр тоққа қосылады, электр шамының жану күшiне қарап электролиттің күшi туралы қорытынды жасалады.
1-кесте
| № | Электролит | Электр шамының жану күші |
| Қанттың ерітіндісі | ||
| Дистилленген су | ||
| Сірке қышқылы | ||
| Азот қышқылы | ||
| Аммоний гидроксиді | ||
| Натрий гидроксиді | ||
| Калий нитраты |
Не үшін ерітiндiлердің концентрациялары бiрдей етіп алынған?
Зерттелген ерітiндiлердiң электрөткізгіштігі неге әртүрлi? Осы электролиттердiң диссоциациялану теңдеулерін жазып, әлсiз электролиттердiң диссоциациялану константасын Кд анықтаңыз.
|
|
|
2-тәжiрибе. Иондық процестер.
а) нашар еритiн негiздердi алу.
Үш пробиркаға 2-3 мл темiр(Ш) хлоридiнiң, марганец сульфатының, магний хлоридінің ертiндiлерiн құйыңыз және 2-3 мл натрий гидроксидiнiң ерітiндiсiн қосыңыз.
б) әлсiз негiздi алу.
Бiр пробиркаға 2-3 мл аммоний хлоридiн құйыңыз және 2-3 мл (С(NaОН)=2моль/л) натрий гидроксидiн қосыңыз. Аздап қыздырыңыз. Иісiнен қандай газ бөлiнетiнiн байқаңыз.
в) нашар еритiн қышқылды алу.
Бiр пробиркаға 2-3 мл натрий силикатының, екiншi пробиркаға 2-3мл аммоний молибдатының ерітiндiсiн құйыңыз. Екi пробиркаға қышқылдардың тұнбалары түзiлгенше тұз қышқылының ерітіндісін қосыңыз.
қолданбалы химия кафедрасы
г) әлсiз қышқылдарды алу.
Бiр пробиркаға 2-3 мл натрий карбонатының ерітiндiсiн, екiншi пробиркаға натрий ацетаты ерітiндiсiн құйыңыз. Екi пробиркаға да тұз қышқылы ертiндiсiн қосыңыз. Бiрiншi пробиркада қандай газ бөлiнедi? Иісiнен екiншi пробиркада қандай қышқыл түзiлгенiн байқауға болады?
д) қиын еритiн тұздарды алу.
Пробиркаға 1-2 мл қорғасын нитратын құйыңыз, содан кейін натрий хлоридін қосыңыз. Түзiлген тұнбаның түсiн байқаңыз. Тұнбаға калий иодидiн қосыңыз. Тұнба түсi қалай өзгередi? Алынған тұнбаға аммоний сульфидің қосыңыз. Тұнбаның түсін байқаңыз. ЕК-дi пайдаланып осы реакциялардың теңдеулерін жазыңыз.
Жұмысты өңдеу
Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Әлсiз электролиттер мен қиын еритiн қосылыстардың (еру кестесі) формулаларының қасына Кд және ЕК мәнiн жазып қойыңыз.
Бақылау сұрақтары
1. Мынандай қыйын еритін тұздарды алудың реакция теңдеулерін жазыңыз: барий сульфатын, барий хроматын, күмiс иодидiн, цинк фосфатын,.
|
|
|
2. 100 мл-де 8,7 г калий сульфаты болатын ерітіндінің молярлық және нормальдық концентрацияларын анықтаңыздар.
3. AgCl-дың таза судағы және 0,1 М KNO3 ерітіндісіндегі ерігіштігін анықтаңыздар.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 7 зертханалық жұмыс
Тұздар гидролизi
 Жұмыстың мақсаты
Жұмыстың мақсаты
Тұздардың гидролиздену реакцияларын зерттеу,
ортаның рН-өзгерiсін және гидролиздiң
температура мен сұйылтуға тәуелді екенін байқау.
Жұмыстың мазмұны
а) Гидролиз кезiнде қышқылдық тұздардың түзiлуi.
б) Гидролиз кезiнде негiздік тұздардың түзiлуi.
в) Бiрнеше тұздардың бірге гидролизденуi.
г) Температура мен сұйылтудың гидролизге әсерi.
Жұмыстың теориялық негізі
Гидролиз деп тұз иондары мен су иондарының арасындағы реакцияны айтады. Реакция нәтижесiнде әлсiз электролиттер түзiледі және ерітiндi ортасының рН өзгереді.
I-жағдай.
Күштi негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi әлсiз қышқылдың анионы арқылы жүредi:
СО32- + НОН 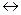 НСО-3 + ОН-
НСО-3 + ОН-
Na2CO3 + HOH 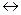 NaHCO3 + NaOH яғни pH > 7.
NaHCO3 + NaOH яғни pH > 7.
II-жағдай.
Әлсiз негiзден және күштi қышқылдан түзiлген тұздың гидролизi әлсіз негіздің катионы арқылы жүредi:
АI3+ + НОН 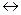 АIОН2+ + Н+
АIОН2+ + Н+
АIСI3 + НОН 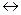 АIОНСI2 + НСI яғни pH < 7.
АIОНСI2 + НСI яғни pH < 7.
III-жағдай.
Әлсiз қышқылдан және әлсiз негiзден түзiлген тұздың гидролизi катион және анион арқылы жүреді.
NН+4 + СН3СОО- + НОН 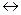 NН4ОН + СН3СООН
NН4ОН + СН3СООН
NН4СН3СОО + НОН 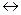 NН4ОН + СН3СООН яғни pH
NН4ОН + СН3СООН яғни pH  7.
7.
IV-жағдай.
Әлсiз негiзден және әлсiз қышқылдан түзiлген тұздың гидролизi бiр саты бойынша жүретін қайтымсыз процес, егер реакция нәтижесiнде түзiлген заттың бiрi газ күйiнде болса:
АI2S3 + 6HOH 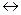 2AI(OH)3
2AI(OH)3 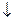 + 3H2S
+ 3H2S 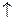 яғни pH
яғни pH  7.
7.
V-жағдай.
Бiрнеше тұздардың бірге гидролизі нәтижесiнде суда ерімейтiн немесе суда кездеспейтiн қосылыстар түзiледi.
АI2(SО4)3 + 3Nа2СО3 + 6HOH = 2АI(ОН)3 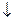 + 3Н2СО3 + 3Nа2SО4
+ 3Н2СО3 + 3Nа2SО4
2АI3+ + 3СО32- + 6НОН = 2АI(ОН)3 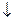 + 3Н2СО3 яғни pH
+ 3Н2СО3 яғни pH  7.
7.
қолданбалы химия кафедрасы
Барлық тәжiрибеде жүрген гидролиз реакцияларының молекулалық және
иондық теңдеулерін жазыңыз, ортаның рН-н және әлсiз электролиттердiң
Кд-н көрсетiңiз (кесте).
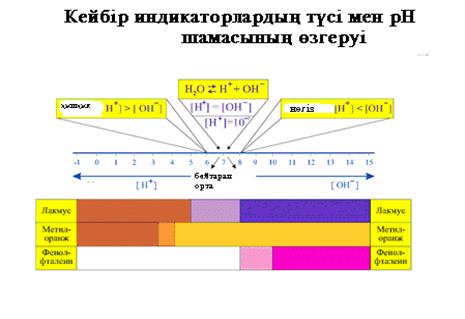

Қолданылатын реактивтер:
Тұздар: калий карбонаты, натрий сульфиты, алюминий хлоридi, магний хлоридi, натрий ацетаты, сурьманың қаныққан ерiтiндiсi, дистилленген су, индикаторлар.
Жұмыстың барысы
1- тәжiрибе. Гидролиз нәтижесiнде қышқылдық тұздардың түзiлуi.
Екi пробиркаға 2-3 мл дистилденген су құйып, 1-2 тамшы фенолфталеин тамызыңыз және микрошпателмен төменгi тұздардың түйірлерін салыңыз:
қолданбалы химия кафедрасы
1-шi пробиркаға калий карбонатын, 2-ге натрий сульфитiн. Әлсiз қышқылдардың диссоциациялану константасын пайдаланып гидролиз реакциясының теңдеуінің бiрiншi сатысын жазыңыз. Қандай тұздың ерiтiндiсiнде фенолфталеиннің бояуы ашық болады? Қандай ерiтiндiде ОН--иондарының концентрациясы жоғарылау болады? Қандай тұздың гидролиздену дәрежесi жоғары болады?
2- тәжiрибе. Гидролиз нәтижесiнде негiздік тұздардың түзiлуi
Екi пробиркаға 3-4 мл дистилленген су құйып, келесi тұздарды ерітiңiз: 1-шi пробиркаға - магний хлоридiн, 2-шi пробиркаға - алюминий хлоридiн салып, универсалды индикатор қағазымен ерітіндінің ортасын анықтаңыздар. Қайсысының рН-ы жоғары болады?
3- тәжiрибе. Екi тұздың бiрге гидролизі
Бiр пробиркаға 6-8 тамшы алюминий хлоридiн құйыңыз. Оған сонша тамшы натрий карбонатын құйыңыз. Пробиркада көмiртегi(IV) оксидiнiң бөлiнетiнін байқаңыз. Осы жағдайда алюминий гидроксидiнiң тұнбасы түзiледi. Не себептен алюминий карбонаты түзiлмейдi?
4- тәжiрибе. Температураның гидролиздену дәрежесiне әсерi
Пробирканың жартысына 1/3 дейiн дистилленген су құйыңыз және оған микрошпателмен 2-3 түйір натрий ацетатын салыңыз. Ерiтiндiнiң рН мәнi қаншаға тең? Пробиркаға 1-тамшы фенолфталеин қосыңыз. Пробирканы ыстық су моншасына салыңыз. Фенолфталеиннің түсi қалай өзгередi? Гидролиз процесінің тепе-теңдiгi қандай бағытта ығысады? Осы құбылыстың себептерін көрсетіңіз.
5- тәжiрибе. Ерiтiндiнi сұйылтудың гидролиздену дәрежесiне әсерi Пробиркаға 2-3 тамшы сурьма(III) хлоридiн құйыңыз оған ақ тұнба сурьма хлороксидi - SbОСI пайда болғанша бiртiндеп тамшылатып су құйыңыз. Бұл тұнба гидролиздiң үшінші сатысында су молекуласы бөлiнiп шығуы нәтижесiнде пайда болады. Түзiлген тұнбаны қалай ерiтуге болады, яғни гидролиздiң иондық тепе-теңдiгiн қалай сол жаққа қарай ығыстыруға болады?
Жұмысты өңдеу
Лабораториялық дәптерге барлық жасалған реакциялардың теңдеулерін молекулалық және иондық түрiнде жазыңыз. Ортаның рН-ын көрсетіңіздер.
Бақылау сұрақтары
1. 1.Мына тұздарды атаңыз: KHSO4, Ca(HCO3)2, Fe(OH)ClO4, CrOHSO4.
2. Na3PO4, Cu(NO3)2, KCl тұздарының гидролиздену реакциясының теңдеуін құрыңыздар.
3. 0,01 M HNO3 ерітіндісінің рОН-ын есептеңіз.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 8 зертханалық жұмыс
Тотығу-тотықсыздандыру реакциялары
 Жұмыстың мақсаты
Жұмыстың мақсаты
Тотығу-тотықсыздандыру реакцияларын жүргiзу.
Элементтердiң тотығу дєрежесiн анықтау арқылы
реакцияны электрондық баланс немесе
иондық-электрондық әдiстері бойынша теңестiру.
Тотығу-тотықсыздандыру реакциясының жүру
жағдайларына тәуелді екенін зерттеу.
Жұмыстың мазмұны
а) Натрий сульфитінің калий перманганатымен әртүрлі ортада тотығуы.
б) Аммоний дихроматының молекула ішілік тотығуы.
в) Иодтың сілтілік ортада диспропорциялануы.
Жұмыстың теориялық негізі
Әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежелері өзгере жүретін реакцияларды тотығу-тотықсыздану реакциялары деп атайды.
Электрондарын беретін молекулаларды, атомдарды немесе иондарды тотықсыздандырғыштар деп атайды. Реакция кезінде олар тотығады.
Электрондарын қосып алатын молекулаларды, атомдарды немесе иондарды тотықтырғыштар деп атайды. Реакция кезінде олар тотықсызданады.
Барлық тотығу-тотықсыздандыру реакциялардың теңдеуiн екi жолмен: электрондық баланс және жартылай иондық әдiспен көрсету керек.
Мысалы: Zn0 + 2HCl 
 Zn2+Cl2- +H20
Zn2+Cl2- +H20
Тотықсыздандырғыш: Zn0 -2е 
 Zn2+ тотығу процессі
Zn2+ тотығу процессі
Тотықтырғыш: 2Н+ +2е  Н20 тотықсыздану процессі.
Н20 тотықсыздану процессі.
Қажетті химиялық реактивтер:
1. Иодтың кристалы.
2. Калий перманганаты, натрий сульфиті, аммоний дихроматы тұздарының ерітінділері.
3. Тұз және күкірт қышқылы.
4. Натрий гидроксидінің ерітіндісі.
Жұмыстың жүру барысы
1-тәжірибе. Натрий сульфитінің калий перманганатымен қышқыл ортада тотығуы.
Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде 2н күкірт қышқылын, сонан кейін натрий сульфитін толық түсі жойылғанша құйыңдар. Марганец қышқыл ортада қандай тотығу дәрежесін көрсетеді?
қолданбалы химия кафедрасы
2-тәжірибе. Натрий сульфитінің калий перманганатымен нейтрал (бейтарап) ортада тотығуы
Пробиркаға 2-3 тамшы калий перманганатын тамызып, сондай мөлшерде натрий сульфитін қосыңдар. Қандай өзгеріс байқалды? Тұнбаға қандай қосылыс түсті? Ерітіндінің түсі қандай? Марганецтің нейтрал ортадағы тотығу дәрежесі неге тең?
3-тәжірибе. Натрий сульфитінің калий перманганатымен сілті ортада тотығуы
Пробиркаға 2-3 тамшы натрий гидроксидін тамызып, сондай мөлшерде натрий сульфитін қосыңдар. Содан кейін 2-3-тамшы калий перманганатының ерітіндісін құйыңдар. Ерітіндінің түсі қандай түске боялды?
4-тәжірибе. Аммоний дихроматының молекула ішілік тотығу-тотықсыздануы
Құрғақ пробиркаға 2-3 шпатель аммоний дихроматын салып, реакция басталып кеткенше қыздырыңдар. Одан кейін қыздыруды тоқтатыңдар. Реакция нәтижесінде түзілген өнімдерге назар аударыңыздар: азот және су буы, қатты хром оксиді.
5-тәжірибе. Иодтың сілтілік ортада диспропорциялануы
Пробиркаға иодтың 1-2 түйірін салып, оған 1-2 мл натрий гидроксидін қосыңыз. Ерітіндінің түсі қалай өзгереді? Сілтілік ортада фтордан басқа барлық галогендерге диспропорциялану реакциясы тән болғандықтан, осы жағдайда натрий иодиді мен натрий иодататы түзіледі.
Жұмысты өңдеу
Лабораториялық журналға тәжірибеде қарастырылған химиялық теңдеулерді жазып, электрондық баланс және жартылай иондық әдіспен теңестіріңдер. Тотықтырғыш пен тотықсыздандырғыштарды табыңдар.
Бақылау сұрақтары:
1. ТТР реакциясы дегеніміз не?
2. Маңызды тотықтырғыштар, мысал келтіріңіз.
3. Маңызды тотықсыздандырғыштар, мысал келтіріңіз.
4. ТТР реакциясын теңестіру әдістері.
5. Тотықтырғыш пен тотықсыздандырғыштың эквиваленттік молярлық массасын есептеңіздер.
Қолданбалы химия кафедрасының
26.08.2014 ж. отырысында
№1 бұйрықпен бекітілді
қолданбалы химия кафедрасы
№ 9 зертханалық жұмыс
Металдардың кернеу қатары және
гальваникалықэлемент

Жұмыстың мақсаты
Металдардың кернеу қатарын және гальваникалық
элементтің схемасы мен электр қозғаушы күшін оқып үйрену.
Жұмыстың мазмұны
а) металдардың кернеу қатары
б) гальваникалық элементтің құрлысымен танысу
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 4232; Нарушение авторских прав?; Мы поможем в написании вашей работы!