
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Азотная кислота. Химические свойства. Взаимодействие с металлами. Нитраты. Обнаружение
|
|
|
|
Аммиак. Получение, химические свойства, применение.
Общая характеристика подгруппы азота.
Серная кислота. Роль в окислительно-восстановительных процессах. Соли серной кислоты. Применение.
Сероводород, получение и свойства. Сероводородная кислота. 1-я и 2-я константы диссоциации. Роль в окислительно-восстановительных процессах. Соли сероводородной кислоты.
Получение:
1) прямой синтез из элементов, при температуре 600 °C;
2) воздействием на сульфиды натрия и железа соляной кислотой.




Оксид SO2 и серная кислота проявляют только окислительные свойства, что обусловлено высшей степенью окисления серы (+6)


11. Соединения серы в степени окисления +4. Роль в окислительно-восстановительных процессах (примеры). Применение.




Могут проявлять в соединениях степени окисления от −3 до +5.

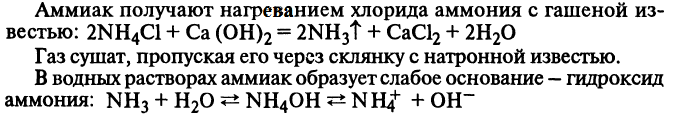




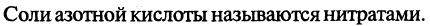
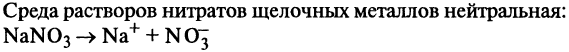




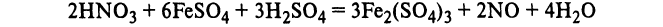
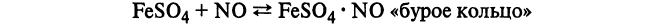

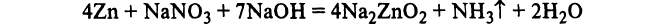

Обнаружение:
В колбу, соединенную с холодильником, конец которого опускают в колбу с водой, помещают исследуемую жидкость и медные опилки. Колбу нагревают на бане с минеральным маслом или на песчаной бане и жидкость выпаривают почти досуха. При достаточной концентрации азотной кислоты происходит восстановление ее медью в окись азота, которая с кислородом воздуха образует двуокись азота (оранжевые пары). Последняя, растворяясь в воде, дает азотную и азотистую кислоты, которые и обнаруживаются химическими реакциями:
3Сu + 2HNO3 = ЗСuО + 2NO + Н2O
3СuО + 6HNO3 = 3Cu(NO3)2 + 3H2O
2NO + O2 = 2NO2; 2NO2 + H2O = HNO2 + HNO3
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 2916; Нарушение авторских прав?; Мы поможем в написании вашей работы!