
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Жесткость воды и методы ее устранения
|
|
|
|
Суммарное содержание ионов Ca2+ и Mg2+ в воде называется ее общей жесткостью. Она подразделяется на карбонатную (временную) и некарбонатную (постоянную). Количественно временную жесткость характеризуют содержанием гидрокарбонатов, удаляющихся из воды при ее кипячении в течение часа. Жесткость, оставшаяся после кипячения, называется постоянной жесткостью. Жесткость воды выражают суммой миллимоль эквивалентов ионов Ca2+ и Mg2+, содержащихся в 1 л воды. Один миллимоль эквивалентов жесткости отвечает содержанию 20,04 мг/л Ca2+ или 12,16 мг/л Mg2+.
Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбонатов кальция и магния. Способы ее устранения основаны на выводе катионов Ca2+ и Mg2+ из воды в виде нерастворимых солей:
1) Кипячение (используется в быту):
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
Mg(HCO3)2 ® Mg(OH)2¯ + 2CO2.
2) Действие известкового молока Ca(OH)2 или соды Na2CO3 (используется в промышленности):
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O
Ca(HCO3)2 + Na2CO3 = CaCO3¯ + 2NaHCO3
Mg(HCO3)2 + Ca(OH)2 = Mg(OH)2 ¯ + CaCO3¯ + CO2 + H2O
Mg(HCO3)2 + Na2CO3 = MgCO3¯ + 2NaHCO3.
Некарбонатная, или постоянная, жесткость обусловлена присутствием сульфатов, хлоридов, нитратов и фосфатов кальция и магния.
Постоянная жесткость при кипячении воды не устраняется. Ее устраняют добавлением соды или фосфата натрия:
CaSO4 + Na2CO3 = CaCO3¯ + Na2SO4
3CaSO4 + 2Na3PO4 = Ca3(PO4)2¯ + 3Na2SO4
Для устранения жесткости методом ионного обмена воду пропускают через слой катионита. Вещества, которые способны обменивать свои ионы на катионы из раствора, называются катионообменниками (катионитами); на анионы из раствора – анионообменниками (анионитами). При этом катионы Ca2+ и Mg2+ обмениваются на катионы Na+, содержащиеся в применяемом катионите.
Жесткость воды может быть рассчитана по формуле:
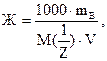 где
где
mB – масса растворенного вещества (г);
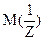 - молярная масса эквивалента вещества (г/моль);
- молярная масса эквивалента вещества (г/моль);
V – объем воды (л).
Также жесткость воды можно вычислить по формуле:
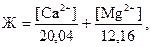 где
где
[Ca2+] и [Mg2+] – концентрации ионов Ca2+ и Mg2+, мг/л.
По значению жесткости воду условно делят на мягкую (до 4 ммоль(экв)/л), средней жесткости (4-8 ммоль(экв)/л), жесткую (8-12 ммоль(экв)/л) и очень жесткую (более 12 ммоль(экв)/л).
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 565; Нарушение авторских прав?; Мы поможем в написании вашей работы!