
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Компоненты в диаграмме железо- углерод
|
|
|
|
Диаграмма состояния железоуглеродистых сплавов
Железоуглеродистые сплавы – стали и чугуны – важнейшие металлические сплавы современной техники. Производство чугуна и стали по объему превосходит производство всех других металлов вместе взятых более чем в десять раз.
Диаграмма состояния железо – углерод дает основное представление о строении железоуглеродистых сплавов – сталей и чугунов.
Начало изучению диаграммы железо – углерод положил Чернов Д.К. в 1868 году. Чернов впервые указал на существование в стали критических точек и на зависимость их положения от содержания углерода.
Компонентами в сплавах железа с углеродом являются металл железо и неметалл углерод.
В промышленности чистое железо практически не используется, а наиболее широко применяются его сплавы. Основными из них являются сплавы железа с углеродом называемые сталями и чугунами.
Диаграмма состояний сплавов в системе железо - углерод дает первостепенные представления и понятия о строении и свойствах их составляющих.
Диаграмму системы железо-углерод можно проанализировать только до образования в ней карбида железа - Fе3С – концентрация углерода 6,67 %. Это связано с тем, что наибольшее практическое значение имеет только часть диаграммы состояния железо-углерод, в которой показано формирование цементита, так как сплавы, содержащие большее количество углерода, очень хрупкие и практически не применяются в промышленности. Поэтому диаграмму состояния системы железо-углерод изображают только до концентрации углерода 6,67 % масс и называют диаграммой состояний железо-цементит
Железо – химический элемент IV периода VIII группы периодической системы элементов Д. И. Менделеева. Химический знак Fe, атомный номер 26, радиус 0,127 нм, масса 55,85, металл.
Железо является одним из наиболее распространенных элементов в природе, уступая лишь кислороду, кремнию и алюминию. Общее его содержание в земной коре составляет 5,1 %. В свободном виде оно находится в падающих на землю метеоритах. Распространены в природе различные соединения железа. Оно входит в состав большинства горных пород и минералов, из которых состоят месторождения железных руд.
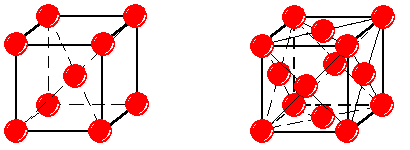 |
Чистое Железо (Fe) имеет температуру плавления 1539ºC, плотность –7,68 - 7,85 г/см3. Металл обладает невысокой твердостью и прочностью НВ» 80, sв» 250 МПа; s0,2 = 120 МПа и хорошей пластичностью; d = 50 %; y = 80 %. В твердом состоянии испытывает два полиморфных превращения. Важнейшее из них – превращение при 911 ºC. Ниже этой температуры железо имеет объемно-центрированную кубическую решетку (ОЦК) с параметром a = 0,286 нм (рис.1, а). Это α-железо (Feα). Выше 911ºC существует γ-железо (Feγ) с гранецентрированной кубической решеткой (ГЦК) и параметром a = 0,364 нм (рис.1, б).
а б
Рис. 1. Кристаллическая решетка a-железа (а) и g-железа (б)
α-железо ферромагнитно, При 768°С у него исчезают ферромагнитные свойства и железо становится парамагнитным, но кристаллическая структура его существенно не меняется. Критическую точку, соответствующую магнитному превращению, т. е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри.
Высокотемпературная модификация Feγ парамагнитна, что позволяет легко обнаруживать тот и другой вид решетки магнитными методами.
В точке 1392°С совершается новое полиморфное превращение, при котором образуется d-Fe с объемноцентрированной кубической решеткой. Это строение железо сохраняет до температуры плавления. Данная модификация - парамагнитна.
Высокотемпературное превращение γ-железа в δ-железо с ОЦК решеткой меньше влияет на структуру и свойства сплавов.
Углерод – химический элемент II периода IV группы периодической системы, химический знак - С, атомный номер 6, радиус 0,077 нм или 0,77 Å; масса 12,011; неметалл. Массовая доля углерода в земной коре составляет 0,1 %. Он встречается в природе в свободном состоянии в двух аллотропических Модифиуациях - алмаза и графита. Алмаз – прозрачное кристаллическое вещество с атомной кубической решеткой. Графит имеет темно-серую окраску с металлическим блеском. Он является жирным на ощупь. По своему строению это слоистое кристаллическое вещество с гексагональной структурой.
Углерод не плавится при нагреве, а возгоняется (переходит в газовую фазу) при температуре 3800ºC. Он мягкий, непрочный, хорошо проводит электричество.
Углерод может растворяться в жидком железе и в решетках обеих полиморфных модификаций, а также образует с железом химическое соединение. Поэтому в сплавах могут присутствовать следующие фазы: жидкий раствор (Ж), феррит (Ф), аустенит (А), цементит (Ц), графит (Г).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 814; Нарушение авторских прав?; Мы поможем в написании вашей работы!