
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства природных газов
|
|
|
|
Газ в месторождении - это всегда смесь, которая характеризуется массовыми или молярными концентрациями компонентов.
Массовая концентрация какого-либо компонента:
 , mi – масса i -го компонента в смеси.
, mi – масса i -го компонента в смеси.
Молярная концентрация:
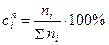 , ni – число молекул i -го компонента в смеси.
, ni – число молекул i -го компонента в смеси.
Можно ввести и объемную концентрацию:
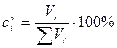 , где Vi –объем i -го компонента в смеси.
, где Vi –объем i -го компонента в смеси.
Но по закону Авогадро, равные объемы любых газов при постоянных давлении и температуре содержат одинаковое число молекул. Например, объем одного кмоля газа при Т =0 °C, P=1атм равен 22,4 м3, т.е. объем i -го компонента пропорционален числу его молей.
Следовательно,  ,
,
т.е. объемный состав газа можно считать равным молекулярному.
Плотность газа может быть найдена по его средней молекулярной массе, которая определяется по молекулярному составу:
 ,
,
где Мi – молекулярная масса компонентов.
Или по массовому составу:

Тогда, плотность смеси газов при нормальных условиях равна:
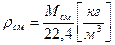 .
.
Относительная плотность газа по воздуху:
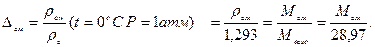
Таблица 2.1.1
Относительная плотность газа по воздуху:
| Газ | Воз-дух | Азот | СО2 | Н2S | СН4 | С2Н6 | С3Н8 | С4Н10 |
| Dсм | 0,97 | 0,518 | 1,191 | 0,55 | 1,038 | 1,52 | 2,0065 |
Из таблицы 2.1.1 видно, что некоторые газы (у которых Dсм>1) могут накапливаться в оборудовании, что является взрывоопасным.
Экспериментально плотность газа rгаза определяют специальными газовыми пикнометрами по скорости истечения газа из малых отверстий, т.к. из кинетической теории газов следует, что  , следовательно
, следовательно  , где r2 – искомая плотность, r1 –, например, плотность воздуха. Т.к. скорость истечения обратно пропорциональна времени, то
, где r2 – искомая плотность, r1 –, например, плотность воздуха. Т.к. скорость истечения обратно пропорциональна времени, то
 , следовательно,
, следовательно, 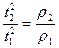 , и
, и 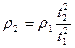 .
.
В пластовых условиях необходимо пересчитать плотность газа на пластовое давление. Полагая газ идеальным, имеем:
 .
.
Следует также иметь в виду, что для смеси идеальных газов справедливы законы Дальтона и Амага.
Закон Дальтона. Общее давление смеси газов, находящихся в определенном объеме, равно сумме парциальных давлений (которыми обладал бы каждый газ, если бы занимал тот же объем один):
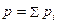 ,
,
где p – общее давление смеси газов; pi – парциальное давление i –го газа в смеси.
Закон Амага выражает аддитивность парциальных объемов компонентов газовой смеси:
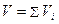 .
.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 655; Нарушение авторских прав?; Мы поможем в написании вашей работы!