
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Радиоактивті ыдырау 7 страница
|
|
|
|
• Сыртқы фотоэффект үшін Эйнштейннің формуласы:

мұндағы 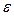 - фотонның энергиясы;
- фотонның энергиясы; 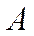 - электронның металдан шығу жұмысы;
- электронның металдан шығу жұмысы; 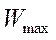 фотоэлектронның максималь кинетикалық энергиясы;
фотоэлектронның максималь кинетикалық энергиясы; 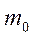 - электронның тыныштық массасы.
- электронның тыныштық массасы.
• Фотоэффекттің қызыл шекарасы:
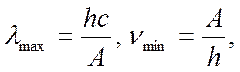
мұндағы 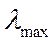 - сәулеленудің максимал толқын ұзындығы;
- сәулеленудің максимал толқын ұзындығы; 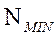 - әлі де фотоэффект мүмкін болатын толқын жиілігі.
- әлі де фотоэффект мүмкін болатын толқын жиілігі.
Фотон - электрмагниттік сәуленің элементар бөлшегі. Фотон зарядсыз бейтарап бөлшек. Ол вакуумде /с, оның тыныштықтағы массасы m=0. Фотон n=he анықталады: n жиілігімен 3*10 8м/с жылдамдықпен тарайды. Оның энергиясы электрмагниттік әсерлесуді тасымалдайтын бөлшек. Зарядталған бөлшектердің Фотондарды шығаруы немесе сіңіруі барлық электро-магниттік процестердің негізі болып табылады. Фотон туралы ұғым кванттық теория мен салыстырмалы теорияның даму барысында пайда болды. 1905 ж. А.Эйнштейн фотоэффект құбылысының заңдылықтарын түсіндіру үшін 1900 ж. нем. физигі М.Планк ашқан жарық кванттары туралы ұғымды пайдаланды. Жарықтың Фотондардан тұратындығы люминесценц. құбылыстар мен фотохим. реакциялар арқылы дәлелденді. “Фотон” терминін ғылымға 1929 ж. америка ғалымы Г.Льюис енгізді. Фотон бозондарға жатады. электромагниттік әсерлесуден басқа Фотон гравитац. әсерлесуге де қатысады. Америка физигі А.Комптонның рентген сәулелерінің бос электрондардан шашы-рауын зерттейтін тәжірибесінде кванттық сәуле шығару да зат бөлшектері сияқты кинематик. заңдарға бағынатындығы дәлелденді. Фотонның зарядталған лептондармен әсерлесуін кванттық электрдинамика зерттейді.
• Фотонның энергиясы:
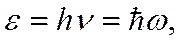
мұндағы 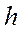 - Планк тұрақтысы;
- Планк тұрақтысы; 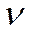 - жарықтың жиілігі;
- жарықтың жиілігі;  - дөңгелек жиілік.
- дөңгелек жиілік.
Фотонның импульсы және массасы:

Классикалық теория бойынша шашыраған сәулелер мен түскен сәулелердің тербеліс жиіліктері бірдей болуы тиіс. Бірақ шашыраған рентген сәулелерінің спертірін зерттеуден бұл пікірдің кейбір жағдайларда орындалмайтындығы байқалады. Мысалы, атомдардың массалары аздау элемент сол сияқты жеңіл элементтерден құралған заттардан шашыраған қатаңдау рентген сәулелерінің құрамында толқынның ұзындығы бастапқы түскен сәулелердікіндей және толқын ұзындықтары одан гөрі ұзынырақ сәулелердің болатындығы анықталды. Рентген сәулесі шашыраған кезде олардың толқындар ұзындығының өзгеруі Комптон құбылысы немесе Комптон эффектісі деп аталады. Жарықтың корпускулалық қасиетінің айқын болуын бірінші рет 1924ж американ физигі Комптон зерттеді. Шашыраған рентген сәулелерінің спектрінде толқын ұзындығыʎ-ға тең бастапқы сәулемен қатар толқын ұзындығы ʎ´ болатынбасқа сәуленің бар екендігі байқалды. Бұл толқын ұзындықтарының айырмасы Δʎ=ʎ´-ʎ шашыратқыш затқа және бастапқы түскен сәуленің толқынының ұзындығына тәуелді болмай тек сәулелердің шашырау бағытына байланысты болады. Комптон эффектісін классикалық электромагниттік теория арқылы түсіндіру мүмкін емес, оны тек кванттық теория бойынша түсіндіреді. Кванттық теория тұрғысынан рентген сәулелері дегеніміз фотондардың ағыны болып табылады. Комптон өзінің тәжірибесінде пайдаланған фотондар энергиясы 17,5 кэ В рентген сәулелері болды.
Комптон эффект кезінде фотонның толқын ұзындығының 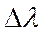 өзгерісі
өзгерісі
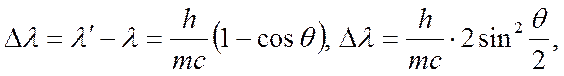
мұндағы 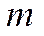 - дүмпілу электронының массасы;
- дүмпілу электронының массасы; 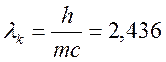 пм- комптондық толқын ұзындығы.
пм- комптондық толқын ұзындығы.
56. Атомдық спектрлердегі заңдылықтар. Атом құрылысы. Бор постулаттары.
Әр түрлі химиялық элементтердің атомдарының сызықтық спектрлері бірдей болмайды. Кейбір элементтердің атомдық спектрі қарапайым болса, кейбіреулерінің атомдық спектрі өте күрделі болады. Мысалы, аргоннын спектрі гелийдің спектрінен, ал гелийдің спектрі сутегінің спектрінен әлдеқайда күрделі болады. Атомдар спектрлерін талдап зерттеу үшін спектрлік сызықтардың толқын ұзындықтары мен салыстырма интенсивтіктерін өте мұқият өлшеу керек болады. Осылайша зерттей келгенде спектрлік сызықтардың орналасуында интенсивтіктері өзгеруде белгілі заңдылық бар екеігдігі байкалады. Мұндай заңдылықтар құрылысы қарапайым спектрлерден өте айқын көрінеді. 1) Сутегі атомының спектріндегі заңдылықтар. Ең қарапайым спектрлердің бірі сутегі атомының спектрі болады. Өйткені сутегінің атомы ең қарапайым атом болады. сутегі атомының спектрінің фотографиясы келтірілген. Мұнда спектрдің көрінетін бөлігі мен жақын ультракүлгін бөлігіндегі спектрлік сызықтар көрініп тұр. Абайлап қарағанда бұл сызықтардың аралығы спектрдің қысқа толқындық шетіне қарай жақындай беретіндігі және осы бағыт бойынша олардың интенсивтігі кеміп отыратындығы ап-анық байқалады. Осы сутегі атомының спектрінің көзге көрінетін бөлігінде жатқан төрт сызық Нα, Нβ, Нγ, Нδ әріптерімен белгіленген. Бұлардың толқындарының ұзындығын (λ) бір формуламен өрнектеуге болады. Оны ең алғаш швейцариялық Бальмер (1885 ж.) тағайындаған.
Сутегі спектріндегі серияларды сипаттайтын Бальмердің жалпылама формуласы:
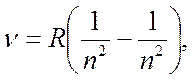
мұндағы 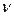 - сутегі атомының спектріндегі спектрлік сызықтардың жиілігі;
- сутегі атомының спектріндегі спектрлік сызықтардың жиілігі; 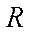 - Ридберг тұрақтысы;
- Ридберг тұрақтысы; 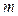 серияны анықтайды (
серияны анықтайды ( );
);  - сәйкес сериядағы жеке сызықтарды анықтайды (
- сәйкес сериядағы жеке сызықтарды анықтайды (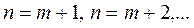 );
);  (Лайман сериясы),
(Лайман сериясы),  (Бальмер сериясы),
(Бальмер сериясы), 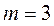 (Пашен сериясы),
(Пашен сериясы), 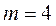 (Брэкет сериясы),
(Брэкет сериясы), 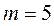 (Пфунд сериясы),
(Пфунд сериясы), 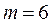 (Хэмфри сериясы).
(Хэмфри сериясы).
Атом құрылысы - 1897 жылы көптеген электр құбылыстарын түсiндiруге мүмкiндiк беретiн жаңалық ашылды. Ағылшын ғалымы Дж.Томсон элементар заряд тасымалдаушысы болып табылатын бөлшектi тапты. Бұл бөлшекті электрон деп атады.
Электрон массасы m=9,1*10-31 кг-ға тең және табиғаттағы ең жеңiл сутегi атомы массасынан 3700 еседей аз болып шықты. Электр зарядын арттыруға және азайтуға болады. Яғни олар әр түрлі мәнге ие болуы мүмкін. Ендеше электр заряды физикалық шама. Екі электрометр алып олардың біреуін зарядтайық. Сосын оқшаулағыш тұтқасы бар жіңішке сыммен екі электрометрді жалғайық. Сонда біз зарядтың теңдей екіге бөлінгенін көре аламыз. Атом құрылысы 1911 жылы ағылшын ғалымы Э. Резерфорд басқарған тәжiрибелер нәтижесiнде ашылған. Электрон заряды терiс: qэл = – е = – 1,6 • 10–19 Кл.
Бұл заряд электронның ерекше сипаттамасы болып табылады. Жәй денелердi зарядтауға немесе разрядтауға болады, ал электронды зарядынан “айыру” мүмкiн емес. Сондай-ақ электрон зарядын азайтуға немесе көбейтуге болмайды. Электрон заряды барлық уақытта тек бiр мәнге ие. Электрондар атом ішінде орналасқан оң зарядталған атомдық ядроны айнала қозғалады. Резерфорд тәжiрибелерiн жоғары сыныптарда егжей-тегжейлi қарастырылады. Мұнда бiз оның тәжiрибе нәтижесiнде жасаған қорытындыларымен шектелемiз.
Резерфорд атомының құрылысын Күн жүйесiне ұқсатты. Күн жүйесiндегi планеталар оған тартылып айналғаны сияқты, электрондар да ядроға тартылып оны айнала қозғалады. Осындай ұқсастығы үшiн Резерфорд ұсынған модельдi планетарлық модель деп атаған. Ядро мен электронның ара қашықтығы олардың өлшемдерiне қарағанда өте үлкен. Егер атомды ойша үлкейткенде ядроның диаметрi он теңгелiктей болса, онда ядро мен электрон ара қашықтығы шамамен бiр километрдей болар едi. Егер барлық электрондар атомдық ядроларға тығыз орналасса, онда ересек адамның денесiнiң көлемi бiр куб миллиметрдiң миллионнан бiр бөлiгiндей болатындығы есептелген. Бiр тектi атомдар жиынтығы химиялық элемент деп аталады. Әр түрлi химиялық элементтердiң атомдары бiр-бiрiнен ядроларының зарядымен және сол ядроны айнала қозғалатын электрондар санымен ерекшеленедi. Мысалы, сутегi атомында жалғыз электрон бар, оттегi атомында – сегiз электрон, ал уран атомында – тоқсан екi. Атомдағы электрондар саны элементтiң Д.И. Менделеев кестесіндегі реттiк нөмiрiмен сәйкес келедi. Осы нөмiр атом ядросының зарядын да анықтайды. Белгiлеу енгiзейiк: Z – элементтiң реттiк нөмiрi, е = атомдағы электрондар саны. Онда атом ядросының және атомдағы барлық электрондардың жалпы заряды үшiн былай жазуға болады: qядро = + Ze, qэл-н = – Ze. Атомдағы электрондардың жалпы зарядын, атом ядросының зарядына қоссақ нөл шығады. Бұл атомның толықтай бейтарап екендiгiн көрсетедi. Бейтарап атомдардан тұратын заттардың молекулалары да бейтарап болады. Кейбiр жағдайларда атомдар бiрнеше электронын жоғалтуы мүмкiн. Атомдар электрондармен бiрге өздерiнiң терiс зарядының бiр бөлiгiн жоғалтып, бейтарап емес жүйеге айналады. Осының салдарынан пайда болған оң зарядталған атомды оң ион деп атайды. Керi жағдайлар да болуы мүмкiн: бейтарап атом өзiне артық электрон қосып алып, терiс зарядталады. Мұндай атомды терiс ион деп атайды.
Даниялық атақты физик Н. Бор Планктың кванттық теориясына сүйене отырып, атомның ядролық моделін жаңа нысанадан қарап талқылады, атомның құрылысы туралы кванттық жаңа теория ойлап шығарды. Бұл жөнде Н. Бор (1913 ж.) мынадай екі постулат ұсынды. Бірінші қағида немесе орнықты күйлер қағидасы: атомдағы электрондар кез келген энергиясы бар орбиталармен емес, тек белгілі бір энергиясы бар орбиталар бойымен қозғалады. Оларды орнықты орбиталар деп атайды. Орнықты орбиталардың энергиясы тек белгілі бір дискретті мәндерді ғана иеленеді. Электрондар мұндай орнықты орбита бойымен қозғалып жүргенде сәуле шығармайды. Екінші қағида немесе сәуле шығарудың жиіліктік шарты: атом бір орнықты күйден екінші бір сондай күйге ауысқанда ғана жарықтың бір фотонын жұтады не шығарады. Шығарылған не жұтылған фотонның энергиясы (һν) екі орнықты күй энергияларының (Е1 және Е2) айырымына тең (һν = Е1 – Е2, мұндағы ν – шығарылған не жұтылған сәуле фотонының жиілігі, һ – Планк тұрақтысы). Осы қағидалар негізінде құрылған Бор теориясы тек сутек және сутек тәріздес атомдардың құрылысын түсіндіруге қолданылады. Бор қағидалары классикалық физика заңдылықтарына толығымен қайшы келеді. Бұл қағидалар – микродүние қасиеттерін түсіндіру үшін табылған алғашқы тұжырымдар. Атом құрылысы кванттық механика арқылы ғана толық түсіндіріледі.
Бордың бірінші постулаты (стационарлық күйлер постулаты):
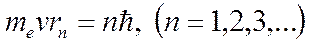 мұндағы
мұндағы 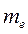 - электронның массасы;
- электронның массасы; 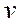 - радиусы
- радиусы  болатын т -ші орбитадағы электронның жылдамдығы.
болатын т -ші орбитадағы электронның жылдамдығы.
• Бордың екінші постулаты (жиіліктер ережесі):
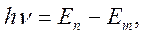
мұндағы 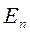 және
және  - сәйкес түрде атомның сәулеленуге (жұтуға) дейінгі және одан кейінгі сатционарлық күйлерінің энергиялары.
- сәйкес түрде атомның сәулеленуге (жұтуға) дейінгі және одан кейінгі сатционарлық күйлерінің энергиялары.
• 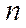 - стационар орбитадағы электронның энергиясы:
- стационар орбитадағы электронның энергиясы:
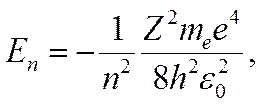
мұндағы 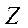 - Мендлеевтің периодтық кестесіндегі элементтің реттік нөмірі;
- Мендлеевтің периодтық кестесіндегі элементтің реттік нөмірі; 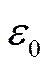 - электрлік тұрақты.
- электрлік тұрақты.
57. Атом ядросы. Атом ядросының құрылысы жəне сипаттамалары. Резерфорд тəжірибесі.
Атом ядросы - протондар мен нейтрондардан (нуклондардан) құралатын атомның ең ауыр, орталық бөлігі. Атом ядросының негізгі сипаттамаларының бірі оның электр заряды болып табылады. Атом ядросының зарядын алғаш рет 1913 жылы Г.Мозли өлшеген. Ал ядроның зарядын тікелей өлшеуді ағылшын физигі Дж.Чедвик 1920 жылы жүзеге асырды. Атом ядросының заряды элементар электр зарядының Менделеев кестесіндегі химиялық элементтің реттік нөміріне көбейтіндісіне тең болады: Сонымен, Менделеев кестесіндегі химиялық элементтің реттік нөмірі кез келген элемент атомының ядросындағы оң зарядтардың санымен анықталады. Сондықтан элементтің реттік нөмірін зарядтық caн деп атайды. Атом ядросының физикалық қасиеттері оның зарядымен қатар массасымен де анықталады. Ядроны сипаттайтын шамалардың ең маңыздыларының бірі — масса. Ядролық физика иондар мен атом ядросының массасын көбінесе масс-спектрографтың көмегімен анықтайды. Ядро да нейтрал атомның символымен белгіленеді: 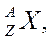
мұндағы 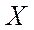 - химиялық элементтің символы;
- химиялық элементтің символы; 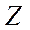 -атомдық нөмір (ядродағы протондар саны);
-атомдық нөмір (ядродағы протондар саны); 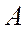 - массалық (ядродағы нуклондар саны));
- массалық (ядродағы нуклондар саны)); 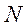 - ядродағы нейтрондар саны
- ядродағы нейтрондар саны 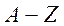 айырымына тең болады.
айырымына тең болады.
Өлшем бірліктерінің Халықаралык жүйесіндегі қолданылатын ұзындықтың, массаның және т.б. өздеріңе таныс өлшем бірліктерімен қатар, ядролық физикада арнайы бірліктер қолданылады. Бұл қажет-тілік ядролық процестердің субатомдық әлемде өтетінінен туындайды.
Мысалы, ядролық физикадағы ең үлкен қашықтық атом радиусының өзі 10-10 м-ге тең. Ұзындық бірлігі ретінде ферми алынады: 1фм = 10-15 м. Массаның бірлігі ретінде көміртегі  атомы массасының бөлігі алынады, ол массаның атомдық бірлігі болып табылады:
атомы массасының бөлігі алынады, ол массаның атомдық бірлігі болып табылады:
1 м.а.б.=1,660546 · 10-27 кг, 1 кг=6,023091 · 1026 м.а.б.
Салыстырмалы атомдық масса атомның абсолюттік массасында неше массаның атомдық бірлігі бар екенін көрсетеді. Мысалы, сутегі үшін Ar= 1,00783, көміртегі үшін Ar = 12,0, оттегі үшін Ar = 15,99482.
Ядролық физикада энергияны электронвольтпен өлшейді,1 эВ = 1,6 · 10-19 Дж.
Еселік мәндер де қолданылады:
1 кэВ =103 эВ; 1 МэВ =106 эВ;1 ГэВ =109 эВ.
Көбінесе элементар бөлшектердің массаларын массаның атомдық бірлігімен қатар энергияның өлшем бірлігі МэВ немесе ГэВ-пен де өлшейді. Сондықтан массаның атомдық бірлігіне сәйкес болатын энергияның эквивалентін анықтайық. Масса мен энергияның өзара байланыста болатыны Эйнштейннің формуласынан белгілі.
Атомдағы электрондар массасы ядроның массасымен салыстырғанда өте аз, оны ескермеуге болады. Сондықтан массаның атомдық бірлігімен алынған және атом массасына ең жақын бүтін санды массалық сан деп атайды. Оны әрпімен белгілейді. Ол жоғары дәлдікті қажет етпейтін есептеулерде, әсіресе массалардың қатынасы кіретін өрнектерде ядро массасының шамасы ретінде қолданылады. Мысалы, гелий атомының массасы MHe = 4,0026 м.а.б. болса, массалық саны A = 4 болады.
Ядроның массасының ахауы:

мүндағы 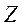 - зарядтық сан (ядродағы протондар саны);
- зарядтық сан (ядродағы протондар саны); 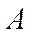 - массалық сан (ядродағы нуклондар саны);
- массалық сан (ядродағы нуклондар саны); 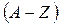 - ядродағы нейтрондар саны;
- ядродағы нейтрондар саны; 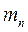 - нейтронның массасы;
- нейтронның массасы; 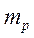 - протонның массасы;
- протонның массасы; 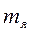 ядроның массасы.
ядроның массасы.
• Ядроның байланыс энергиясы: 
мұндағы  - ядроның массасының ахауы;
- ядроның массасының ахауы; 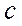 - вакуумдегі жарық жылдамдығы.
- вакуумдегі жарық жылдамдығы.
Жүйеден тыс бірліктерде ядроның байланыс энергиясы 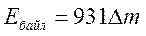 болады, мұндағы
болады, мұндағы  - массаның ахауы, м.а.б.-мен (1м.а.б.
- массаның ахауы, м.а.б.-мен (1м.а.б. 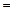 931 МэВ).
931 МэВ).
Резерфорд тәжірибесі
1911 жылы ағылшын физигі Резерфорд атомның ядролық моделін ұсынды. Резерфорд өзінің шәкірттері Г.Гейгер және Э. Марсденмен бірге альфа-бөлшектер шоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді.
Тәжірибе барысында өте жұқа (l=6*10-7 м) алтын фольганы энергиясы 7,68 МэВ жылдам альфа бөлшектермен атқылаған. Қорғасын контейнердің түбінде орналасқан 21484 Ро радиоактивті элементтен шыққан альфа-бөлшектердің жіңішке шоғы алтын фольгадан өткенде шашырайды, яғни алғашқы бағытынан ауытқиды. Ол кезде альфа-бөлшектердің оң заряды (2е) гелий иондары екені белгілі болатын. Фольгадан шашыраған альфа-бөлшектердің қаншасы қандай бұрышқа ауытқығанын есептей отырып, осы ауытқуларды тудырған нысана-атомдардың құрылымы анықталады. Фольганың қалыңдығы өте аз болғандықтан, одан өткенде әрбір альфа-бөлшек тек бір атоммен ғана әсерлеседі, яғни бір-ақ рет шашырауға ұшырайды деп есептеуге болады. Шашыраған альфа-бөлшектер күкіртті цинкпен (ZnS) қапталған экранға келіп соғылады. Күкіртті цинк молекулаларының альфа-бөлшекпен соқтығысқанда сәуле шығаратын қасиеті бар. Сондықтан экранның альфа-бөлшек соғылған жерлерінде сцинтилляция, яғни өте әлсіз жарқыл байқалады. Тәжірибенің мақсаты берілген уақыт аралығында байқалатын жарқылдардың φ ауытқу бұрышына тәуелділігін анықтау.
Тәжірибенің нәтижесінде альфа-бөлшектердің басым көпшілігі фольгадан өткенде алғашқы бағыттан ауытқымайтыны (φ≈1 – 2°) анықталды. Бұл нәтиже, негізінен, Томсон моделіне сүйеніп жасалған есептеулермен дәл келді. Бірақ, альфа-бөлшектердің мардымсыз аз бөлігі 90°-тан артық бұрышқа ауытқитыны, яғни олар фольгаға соғылып, кері бағытта ұшатыны таңдандырды. Сегіз мыңға жуық бөлшектердің біреуі ғана осындай үлкен бұрышқа ауытқиды екен! Мұны Томсон моделі негізінде түсіндіру тіпті мүмкін болмады.
Тәжірибеде алынған нәтижелерді зерделей отырып Резерфорд өз моделін ұсынды. Ол атомның оң заряды оның ортасында орналасқан радиусы шамамен 10-15 м өте аз көлемге жинақталған деген қорытындыға келді. Бірақ орталық бөлшекті Резерфорд ядро деп атады. Атомның массасын түгел дерлік ядрода шоғырланған. Ядроны айнала әр түрлі орбиталармен электрондар қозғалып жүреді. Бұл үлгі Күн жүйесінің құрылымына ұқсайтын болғандықтан, оны атомның планетарлық моделі деп те атайды. Модель бойынша атом көлемінің басым көпшілік бөлігі «бос» болып шығады, ядроның радиусы атомның радиусынан 100000 есе кіші. Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап.
Атомның ішіндегі бос кеңістік «өте үлкен». Сондықтан, фольга арқылы өткенде альфа-бөлшектерінің көбі ядродан алыс өтеді де, шашырамайды. Электрондар альфа-бөлшектен 8 мың еседей жеңіл болғандықтан, оның қозғалыс траекториясын өзгерте алмайды. Тек ядроға тікелей қарсы келіп қалған альфа-бөлшектер ғана онымен әсерлесін, кері ұшады. мұндай бөлшектер саны ядро радиусының атом радиусына қатынасымен анықталады.
Жоғарыда біз тәжірибеге тек сапалық талдау жүргіздік. резерфорд сонымен қатар өз моделінің және Томсон моделінің негізінде есептеу жұмыстарын жүргізді, олардың нәтижесінде Резерфорд үлгісінің дұрыстығын көрсетті. Бірақ классикалық физика тұрғысынан мұндай атомның орнықты болуы мүмкін емес. Бұдан бұрын айтылғандай, зарядталған бөлшек үдемелі қозғалса, міндетті түрде сәулеленуі керек. Бұл сәулеленудің жиілігі электронның ядро маңында айналу жиілігіне тең болуы тиіс. Электрон ядроны айнала дөңгелек орбитамен қозғалса, оның центрге тартқыш үдеуі бар. Олай болса, электрон сәуле шығара отырып, өз энергиясын азайтуы тиіс. Энергияның азаюы электронның ядроға кулон күшінің әсерінен біртіндеп жақындап, ақыры оған құлап түсуіне әкеп соғады. бұған бар болғаны 10-8 с-қа тең уақыт кетеді екен және классикалық теория бойынша мұндай атомның сәулелену спектрі тұтас болу керек
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1457; Нарушение авторских прав?; Мы поможем в написании вашей работы!