
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химических реакций
|
|
|
|
Классификация химических реакций.
Катализаторы и каталитические процессы.
Энергия активации.
Влияние температуры на скорость химической реакции.
Скорость химической реакции.
Классификация химических реакций.
ХИМИЧЕСКая кинетика и катализ
5. Формула Максвелла – Больцмана
Все кинетические реакции различаются по молекулярности и порядку реакций. Молекулярность реакции определяется числом молекул, участвующих в химическом взаимодействии.
По молекулярности все реакции делятся на:
- мономолекулярные - в которых участвуют одна молекула, например: I2Û2I, все реакции изомерного превращения и разложения.
- бимолекулярные: во взаимодействии участвуют две молекулы, пример: H2+I2Û2HI.
- тримолекулярные: при одновременном столкновении 3х молекул: 2NOÛ2NO2, но вероятность встречи одновременно 3х молекул крайне низка.
Реакция более высокой молекулярности, чем 3х не известны.
В тех случаях, когда из уравнения реакции следует, что молекулярность более 3х, на самом деле реакция протекает более сложным путем - проходит через ряд промежуточных стадий, молекулярность которых, как правило, 1 или 2.
Каждому типу реакций соответствует кинетическое уравнение, которое выражает зависимость скорости химической реакции от концентрации реагирующих веществ. По форме зависимости скорости от концентрации V = f(с) реакции делятся на первого второго и третьего порядка. В реакциях второго, третьего порядка v зависит от с во второй и третьей степени.
В общем случае порядок реакции определяется как сумма стехиометрических коэффициентов взаимодействующих реагентов.
aA+bBÛcC+dD порядок данной реакции n=a+b, т.е. на первый взгляд порядок реакции совпадает с ее молекулярностью. Но это совпадение наблюдается лишь в самых простых случаях. Многие, например бимолекулярные реакции, описывают кинетическим уравнением первого порядка. Такое понижение порядка, как правило, следствие того, что один из реагентов находится в большом избытке, и в процессе реакции его (С) изменяется незначительно, т.е. u реакции зависит только от изменения (С) другого компонента.
Пример: C12H22O11+H2OизбÛ2С6H12O6 – гидролиз тростникового сахара.
Причина несовпадения молекулярности и порядка реакций объясняется тем, что стехиометрические уравнения описывают процесс в целом и не отражают истинного механизма реакций, протекающих через ряд последовательных стадий.
Под скоростью химической реакции понимается изменение концентрации реагирующих веществ в единицу времени.
Чтобы вычислить u реакции нужно определить, насколько изменилась концентрация одного из реагирующих веществ в единицу времени (рис. 1).
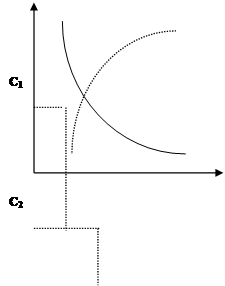 |
|
|
Dt=t2-t1, -DC=C2-C1 Þ u= -DC/Dt
Знак минус говорит о том, что с уменьшением С скорость тоже уменьшается. Если u рассчитывается по одному из продуктов реакции, то u=DC/Dt. Несмотря на знак минус в уравнении u считается положительной величиной.
Более применимое вычисление скорости хим. реакции вытекает из закона действия масс.
Согласно этому закону u~ концентрации реагирующих веществ в данный момент времени. Для реакции А®В, u может быть выражена следующим кинетически уравнением: u=КСА, где СА - концентрация вещества А в данный момент времени, К - коэффициент пропорциональности - константа u химических реакций.
При взаимодействии 2х и более веществ mA + nB ®pC + gD, математическое выражение скорости будет: u=KCAmCBn. т.е. u химических реакций прямо пропорциональна произведению реагирующих веществ, стехиометрические коэффициенты входят в уравнения в виде степени при соответствующей концентрации.
Константа u химической реакции не изменяется при изменении концентраций реагирующих веществ. Иногда К называют удельной скоростью реакции, т.е. при СА = СВ = 1, К = u.
Константа скорости зависит от природы реагирующих веществ, t0, присутствия примесей (в том числе катализаторов), от среды в которой протекает реакция.
Чем больше константа скорости, тем быстрее идет реакция.
3. Влияние t0 на скорость химической реакции.
Опыт показывает, что с повышением t0 скорость химических реакций возрастает. В уравнении химической кинетике u=КCАСВ влияние t0 включает в себя К. С увеличением t0 возрастает К Þ и возрастает u.
Если через Кt - конст. при t0 = t0, а Kt+10 при t0=t0+10 его, то отношение величины первой называется температурным коэффициентом скорости реакции (g),
g= Kt+10/ Kt.
Согласно эмпирическому правилу Вант-Гоффа g колеблется от 2 до 4, т.е. повышая t0 на 100 u возрастает в два- четыре раза.
Пример если g = 2, t0 + 1000, то скорость реакции увеличится в 1024 раза, т.е.
Kt+100/ Kt=g10=210=1024.
увеличение температуры в арифметической прогрессии, влечет за собой увеличение скорости реакции, в геометрической.
Хотя из правила Вант-Гоффа коэффициент g должен быть постоянным для каждой химической реакции, это справедливо лишь на очень узком интервале температур. При значительных перепадах температуры g значительно уменьшается при увеличении температуры (рис. 2).
 |
Точная зависимость К скорости реакции от t0 была найдена Аррениусом. Уравнение Аррениуса имеет вид:
lnK=B - A/T
где К - константа u реакции; А и В - постоянные характерные для данной реакции; Т - температура.
как видно из уравнения lnК обратно пропорционален Т. Коэффициенты А и В находят графически (рис. 3).
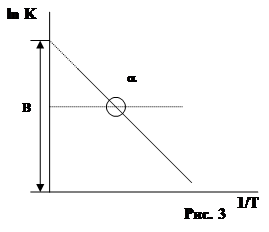 |
|
|
|
|
|
Дата добавления: 2014-12-17; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!