
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Собственный момент электрона
|
|
|
|
Итак, атом обладает механическим моментом импульса, и его существование влияет на спектры атомов. Поскольку в состав атома входят заряженные частицы, то при рассмотрении их движения необходимо учитывать магнитные свойства.
Известно, что атом обладает также магнитным моментом pm, который обусловлен движением электрона вокруг ядра (курс «электромагнетизм»). Магнитный момент pm пропорционален механическому моменту атома (знак «–» свидетельствует о противоположном направлении векторов механического и магнитного моментов).
 (7.14)
(7.14)
где 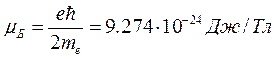 – магнетон Бора (см. курс «Электромагнетизм»).
– магнетон Бора (см. курс «Электромагнетизм»).
Существование магнитного момента атома должно проявляться в следующем: атом, находящийся в заданном состоянии (n, l) имеет 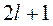 возможных ориентаций в пространстве векторов
возможных ориентаций в пространстве векторов  (рис. 7.3) и столько же противоположно направленных векторов
(рис. 7.3) и столько же противоположно направленных векторов 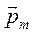 , следовательно, вектор
, следовательно, вектор 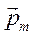 может иметь только
может иметь только 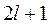 значений проекции магнитного момента на заданную ось. Если вдоль указанной оси действует магнитное поле, то влияние поля на атом будет зависеть от того, каким из возможных значений проекции магнитного момента обладает этот атом. Первыми данный эффект обнаружили О. Штерн и В. Герлах в 1922 г. За эту и ряд других работ по физике молекулярных пучков Штерн был удостоен Нобелевской премии.
значений проекции магнитного момента на заданную ось. Если вдоль указанной оси действует магнитное поле, то влияние поля на атом будет зависеть от того, каким из возможных значений проекции магнитного момента обладает этот атом. Первыми данный эффект обнаружили О. Штерн и В. Герлах в 1922 г. За эту и ряд других работ по физике молекулярных пучков Штерн был удостоен Нобелевской премии.
Устройство И (печь) на рис. 7.6 служило источником атомов серебра. Позднее этот эксперимент был повторен для других атомов, в том числе и для атомов водорода. Результаты этих экспериментов аналогичны. С помощью системы щелей ВВ' отсекались атомы, летящие не вдоль оси, указанной пунктиром. Оставшийся узкий пучок атомов падал на регистрирующую пластинку. Если магнитного поля на пути атомов нет, на пластинке регистрировалась одна линия.
На пути атомов можно было создать неоднородное магнитное поле SN, в котором z -компонент магнитного поля B слегка увеличивался в направлении z, а компоненты Вх и Ву были постоянны вдоль направлений х и у соответственно.
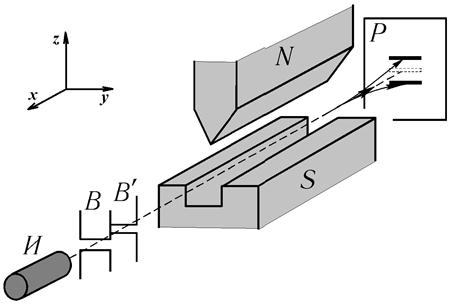
Рис. 7.6. Опыт Штерна и Герлаха
При включении магнитного поля для атомов серебра вместо одного пятна на пластинке фиксировалось 2 симметричных пятна. Расщепление пучка в неоднородном магнитном поле может являться следствием того, что каждый атом обладает магнитным моментом pm, поэтому на него со стороны внешнего поля действует сила:
 (7.15)
(7.15)
Так как магнитный момент атома пропорционален механическому моменту M и следовательно может принимать несколько дискретных значений, то угол отклонения движения атома, диктуемый силой (7.15), зависит от направления 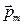 и также может принимать несколько дискретных значений. В частности атомы серебра, заведомо находящиеся в основном состоянии, должны давать одну линию, т.к. основным для него является состояние 5s (т.е. l = 0). Следовательно, ml может принимать единственное значение ml = 0, и pm будет иметь единственно возможную ориентацию (направление) в пространстве. Таким образом, ожидалось, что при наличии магнитного поля линия на пластинке отклонится, но останется единственной. Наличие двух линий вместо одной свидетельствует о неком внутреннем свойстве атома (точнее сказать – электрона, как потом выяснилось), которое приводит к смещению траектории всего атома в магнитном поле в ту или другую сторону. Очевидно, что используемый набор квантовых чисел является недостаточным для понимания физической причины расщепления – требуется введение еще одного квантового числа, которое описывает состояние электрона в атоме и принимает одно из двух возможных значений. Тогда атомы, в которых электронам соответствует одно из этих значений, будут смещаться в одну сторону (на рис. 7.6 вверх), а атомы, в которых электронам соответствует второе из этих значений – в другую сторону (на рис. 7.6 вниз).
и также может принимать несколько дискретных значений. В частности атомы серебра, заведомо находящиеся в основном состоянии, должны давать одну линию, т.к. основным для него является состояние 5s (т.е. l = 0). Следовательно, ml может принимать единственное значение ml = 0, и pm будет иметь единственно возможную ориентацию (направление) в пространстве. Таким образом, ожидалось, что при наличии магнитного поля линия на пластинке отклонится, но останется единственной. Наличие двух линий вместо одной свидетельствует о неком внутреннем свойстве атома (точнее сказать – электрона, как потом выяснилось), которое приводит к смещению траектории всего атома в магнитном поле в ту или другую сторону. Очевидно, что используемый набор квантовых чисел является недостаточным для понимания физической причины расщепления – требуется введение еще одного квантового числа, которое описывает состояние электрона в атоме и принимает одно из двух возможных значений. Тогда атомы, в которых электронам соответствует одно из этих значений, будут смещаться в одну сторону (на рис. 7.6 вверх), а атомы, в которых электронам соответствует второе из этих значений – в другую сторону (на рис. 7.6 вниз).
Для объяснения описанного эффекта в 1925 году голландские ученые Д. Уленбек и А. Гаудсмит высказали гипотезу, что электрон, совершая вращательные движения вокруг своей оси, обладает собственным моментом импульса. В связи с тем, что особенные свойства электрона связывали с вращением, его собственный момент импульса был назван «спин» – от английского spin (веретено, кручение).
Позднее оказалось, что если электрон рассматривать как вращающийся вокруг своей оси шарик, то возникают некоторые противоречия. Например, согласно расчетам электрон в этом случае должен двигаться со скоростью больше скорости света. Т.е. электрон неверно считать телом, вращающимся вокруг собственной оси, однако название «спин» закрепилось. Спин – это внутреннее свойство электрона, присущее ему наряду с массой и зарядом, имеющее квантово-релятивистскую природу и отражающее его поведение при взаимодействии с другими квантовыми объектами. Позднее доказали теоретически и подтвердили экспериментально, что спином обладают все квантовые частицы.
Величина собственного механического момента импульса электрона постоянна и определяется спиновым квантовым числом s, равным 1/2:
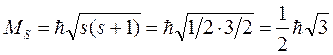 (7.16)
(7.16)
Меняться может направление спина, но возможные направления также строго определенны – спин может быть направлен только таким образом, что проекция спина на заданное направление будет кратной ħ:
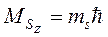 (7.17)
(7.17)
где 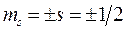 – спиновое квантовое число.
– спиновое квантовое число.
Кроме того, электрону, обладающему собственным механическим моментом, соответствует собственный магнитный момент, равный:
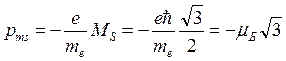 (7.18)
(7.18)
Знак «–» означает, что механический и магнитный спиновые моменты направлены в противоположные стороны.
Тогда проекция собственного магнитного момента на заданную ось может иметь следующие два значения:
 (7.19)
(7.19)
Знак «–» будет, если 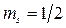 , «+» будет, если
, «+» будет, если 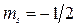 .
.
Если в формулу (7.15) вместо магнитного момента атома подставить собственный магнитный момент электрона 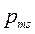 , имеющий в магнитном поле два возможных направления, появление двух линий вместо одной в опыте Штерна и Герлаха становится очевидным.
, имеющий в магнитном поле два возможных направления, появление двух линий вместо одной в опыте Штерна и Герлаха становится очевидным.
Итак, атом обладает механическими орбитальным M и магнитным pm моментами, которые определяются количеством электронов в атоме, а также их энергетическим состоянием в атоме. В тоже время каждый электрон, входящий в атом, обладает собственными механическим MS и магнитным pms моментами. Можно найти результирующий механический момент атома. Для этого необходимо сложить орбитальный M и спиновый MS моменты, величина результирующего момента равна:
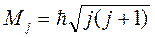 (7.20)
(7.20)
где j – квантовое число полного момента, которое может принимать значения:
 (7.21)
(7.21)
Как было сказано выше, механическим моментам атома и электрона соответствуют магнитные моменты. Собственный магнитный момент электрона ощущает магнитное поле, которое создается своим же атомом в результате движения электрона по орбите вокруг ядра. Магнитные моменты pm атома и pms электрона взаимодействуют (как любые токи). Энергия ∆E этого взаимодействия, называемого спин-орбитальным взаимодействием, зависит от взаимной ориентации орбитального и спинового моментов. Другими словами, состояния атома с различными квантовыми числами j (вычисленными по формуле 7.21), будут иметь различную энергию. Результатом такого взаимодействия является расщепление спектральных линий атомов.
Например, в спектре атома натрия наблюдается так называемый дублет – две близко расположенные линии. Возбуждение валентного электрона (находящегося на уровне 3s) происходит в процессе газового разряда, в результате которого электрон переходит в возбужденное состояние 3p. Обратный переход в зависимости от спинового состояния электрона происходит по схемам:
32P1/2 → 32S1/2 или 32P3/2 → 32S1/2 (7.22)
Здесь нижние индексы равны квантовому числу j и отражают полный момент атома в указанном состоянии.
Т.о., в зависимости от того, как ориентированы в пространстве друг относительно друга магнитные собственный и орбитальный моменты, энергия кванта излучения атома натрия может иметь два значения, отличающихся на величину энергии спин-орбитального взаимодействия ∆E. Для указанных переходов расчетное значение ∆E = 6.78·10–3 эВ (что соответствует разнице длин волн Δλ = 0.53 нм). Разница измеренных экспериментально длин волн линий в дублете натрия составляет 0.59 нм. Это довольно малая величина, вследствие чего указанное расщепление уровней было названо тонкой структурой спектральных линий. В более сложных атомах возможно расщепление на три, четыре и более составляющих, эти группы принято называть соответственно триплет, квинтет и т.д. Некоторые линии в спектрах атомов могут даже с учетом расщепления оказываются одиночными, такие линии называют синглетами. S -состоянию (l = 0) всегда соответствует одно значение энергии, т.е. такое состояние является синглетным, тонкой структуры оно не имеет. Мультиплетность (число компонентов в группе линий) отмечают на схемах в верхнем индексе (например, в переходах 7.22 мультиплетность равна 2, соответственно в спектре наблюдается дублет вместо одной линии).
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 3489; Нарушение авторских прав?; Мы поможем в написании вашей работы!