
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Абсорбционная и дифференциальная спектрофотометрия белков
|
|
|
|
Спектр поглощения белка в УФ-области (230—310 нм) определяется поглощением ароматических аминокислот: триптофана, тирозина и фенилаланина. УФ-свет поглощают хромофорные группы этих аминокислот: индольное кольцо триптофана, фенольное кольцо тирозина и бензольное кольцо фенилаланина.
Основным законом абсорбционной спектрофотометрии является закон Ламберта-Бэра:
I=I0×e-elc, (1)
где I ¾ интенсивность света, прошедшего через раствор концентрацией с (моль ×л-1); I0 — интенсивность света, падающего на кювету; l – толщина кюветы; e – молярный коэффициент экстинкции (моль-1 х м-1).
Закон Ламберта—Бэра в логарифмической форме запишется следующим образом:
D= elc, (2)
где D—оптическая плотность раствора.
Зависимость D или e от длины волны поглощенного света называется спектром поглощения: D=¦(l). Спектральные приборы, которые измеряют спектры поглощения или пропускания вещества, называются спектрофотометрами. На рис.2 изображена блок-схема двухлучевого спектрофотометра.
Спектр поглощения триптофана (рис.1а) имеет максимум поглощения lmax = 280 нм и небольшой пик 288 нм. Молярный коэффициент экстинкции e280=5,6×105 моль-1×м-1. Максимум спектра поглощения тирозина lmax= 275 нм и e275= 1,25×105 моль-1×м-1. Наиболее слабое поглощение имеет фенилаланин: lmax = 257.5 нм и e257.5=0,19×105 моль-1×м-1. Таким образом, характерная полоса поглощения белка с lmax = 280 им представляет в основном сложение спектров поглощения триптофановых и тирозиновых остатков.
При конформационных перестройках белковых молекул происходит небольшое смещение спектра (меньше 1,0 нм), которое трудно регистрировать на спектрофотометрах. Для повышения чувствительности метода используется дифференциальная спектро-фотометрия. Под дифференциальным спектром понимают разностный спектр, получаемый при автоматическом вычитании из спектра поглощения вещества в измеряемой кювете спектра поглощения вещества в кювете сравнения.Если спектр поглощения в кювете сравнения D(l), а при действии определенного фактора в измеряемой кювете наблюдается смещенный на Dl спектр D(l+Dl), тогда дифференциальный cпектр будет:
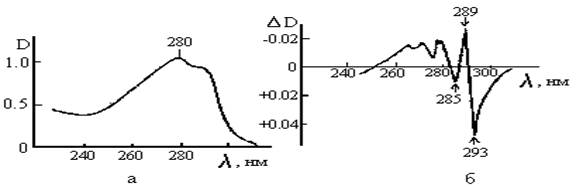
Рис.1. Спектр поглощения (а) и темиературно-пертурбационный дифференциальный спектр (б) триптофана в воде;(рН == 7,0):
градиент температуры DT=10°; DD – дифференциальная оптическая плотность.
DD(l) = D(l+Dl) – D(l) (3)
Если разложить (4.11) в степенной ряд по малому параметру Dl и пренебречь членами второго порядка малости, тогда
 (4)
(4)
В первом приближении дифференциальный спектр соответствует первой производной  от спектра поглощения. Таким образом, вместо регистрации небольших спектральных сдвигов Dl точно измеряют интенсивность дифференциального поглощения DD на чувствительных дифференциальных спектрофотометрах.Методы абсорбционной и дифференциальной спектрофотометрии широко используются для определения различных констант равновесия диссоциации низкомолекулярных лигандов, констант скорости ассоциации субъединиц в белках, конформационных изменений в белках, включая процессы денатурации и ренатурации белков (см. рис. 4). Конформациониое состояние белковой глобулы оценивается определением доступности хромофорных групп (триптофанилов и тирозинов) для внешних пертурбантов.
от спектра поглощения. Таким образом, вместо регистрации небольших спектральных сдвигов Dl точно измеряют интенсивность дифференциального поглощения DD на чувствительных дифференциальных спектрофотометрах.Методы абсорбционной и дифференциальной спектрофотометрии широко используются для определения различных констант равновесия диссоциации низкомолекулярных лигандов, констант скорости ассоциации субъединиц в белках, конформационных изменений в белках, включая процессы денатурации и ренатурации белков (см. рис. 4). Конформациониое состояние белковой глобулы оценивается определением доступности хромофорных групп (триптофанилов и тирозинов) для внешних пертурбантов.
2.3.Температурно-пертурбационная дифференциальная
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1628; Нарушение авторских прав?; Мы поможем в написании вашей работы!