
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Питання до індивідуального завдання
|
|
|
|
Індивідуальне завдання студента складається з п'яти питань, три з яких теоретичні, два - розрахункові задачі. Номера питань індивідуального завдання розраховується студентом за номером залікової книжки:
Номер першого питання дорівнює сумі двох останніх цифр залікової книжки студента (якщо дві останні цифри залікової книжки 00, тоді перше питання - 1.20).
Номер другого питання дорівнює останній цифрі номера залікової книжки (якщо остання цифра «0», потрібно брати десяте питання).
Номер третього питання дорівнює передостанній цифрі номера залікової книжки (якщо передостання цифра «0», потрібно брати десяте питання).
Дані для четвертого питання вибираються так: вміст вуглецю в сплаві - 0,01 помножене на останню цифру залікової книжки, а вміст хрому - передостання цифра залікової книжки (якщо остання цифра «0», множиться на 10).
Дані для п'ятого питання вибираються по останній цифрі номера залікової книжки (якщо остання цифра «0», потрібно брати десяте питання).
Наприклад, останні дві цифри залікової книжки 57, тоді перше питання 1.12 (5+7=12), друге питання 2.7, третє питання 3.5; дані для четвертого питання -
| мас.% | С | Si | Mn | Cr | Ni | Mo | V |
| 0,07 (7 помножити на 0,01) | 0,2 | 0,3 | 5 (передостання цифра залікової книжки) | 0,3 |
п'яте питання - 5.7.
останні дві цифри залікової книжки 30, тоді перше питання 1.3 (3+0=3), друге питання 2.10, третє питання 3.3, дані для четвертого питання
| мас.% | С | Si | Mn | Cr | Ni | Mo | V |
| 0,1 (10 помножити на 0,01) | 0,2 | 0,3 | 3 (передостання цифра залікової книжки) | 0,3 |
п'яте питання - 5.10.
Завдання до першого питання
1.1. Розглянути сутність процесу дисоціації карбонатів, навести величини, що є критерієм міцності карбонатів. Обчислити значення цих величин для реакцій утворення карбонатів кальцію, магнію й заліза для температур 900, 1100, 1300 0С. За результатами розрахунків зробити висновок про вплив температури на міцність карбонатів, про порівняльну міцність карбонатів.
1.2. Які величини є мірою міцності оксиду? Який зв'язок між цими величинами й міцністю оксиду? Наведіть графік, що характеризує залежність пружності дисоціації оксиду від температури, розгляньте кожну область, виявіть умови утворення й дисоціації оксиду.
1.3. Викласти сутність термографічного методу дослідження в застосуванні до вивчення процесів дисоціації хімічних сполук, зокрема, карбонатів.
1.4. Зробити термодинамічний аналіз процесів утворення й дисоціації за допомогою зміни стандартної енергії Гіббса. Зробити висновок про порівняльну міцність оксидів нікелю, хрому заліза й марганцю.
1.5. Розглянути термодинаміку дисоціації карбонатів кальцію, магнію, заліза й доломіту, зробити висновок про відносну міцність карбонатів, відзначити область їхнього застосування.
1.6. Як побудований ряд елементів по спорідненості до кисню? Яке практичне значення мають ці залежності?
1.7. Температура початку дисоціації хімічної сполуки, температура хімічного кипіння. Які методи визначення цих температур? Наведіть приклади.
1.8. Розглянути систему Fe-O, написати реакції утворення оксидів, дати характеристику кожного оксиду, оцінити порівняльну міцність.
1.9. Викласти сутність принципу Байкова про ступінчастість перетворень у системі Me-O (для приклада розглянути перетворення в системі Mn-О).
1.10. Навести діаграму стану системи залізо-кисень, розглянути всі області цієї діаграми.
1.11. Користуючись діаграмою стану Fe-O, побудувати ізотерму пружності дисоціації оксидів заліза при температурі 1200 0С.
1.12. Навести діаграму стану системи залізо-кисень, виділити двофазні області й охарактеризувати їх.
1.13. Навести діаграму стану системи залізо-кисень, виділити трифазні області й охарактеризувати їх.
1.14. Навести діаграму стану системи залізо-кисень. Користуючись діаграмою, розглянути будову окалини при температурі нижче и вище 570 0С.
1.15. Розглянути вплив структури окисної плівки на швидкість окислювання металу.
1.16. Розглянути термодинаміку основних реакцій системи С-О.
1.17. Порівняти відновлювальну здатність СО і Н2, окислювальні властивості СО2 і Н2О.
1.18. Викласти термодинамічний аналіз реакції газифікації вуглецю вуглекислим газом.
1.19. Розглянути графік спорідненості металів до кисню, як вплине температура на відновлювальні властивості вуглецю. Визначити температуру, вище якої вуглець відновлює нікель, залізо, марганець, вольфрам і кремній.
1.20. Користуючись графіком зміни хімічної спорідненості елементів до кисню залежно від температури, визначити поводження елементів й їхніх оксидів в умовах відновлювальної й окислювальної плавки.
Завдання для другого питання
2.1. Викласти основні технологічні функції металургійних шлаків, розглянути класифікацію шлаків за складом.
2.2. Розглянути вплив хімічного складу шлаків і температури на в'язкість шлаків.
2.3. Зробити термодинамічний аналіз процесів відновлення оксидів заліза окисом вуглецю. Аналіз виконати за допомогою графіка впливу температури на рівновагу реакцій непрямого відновлення.
2.4. Викласти сутність алюмотермічного відновлення, область застосування.
2.5. Розглянути термодинаміку реакцій відновлення оксидів заліза твердим вуглецем.
2.6. Зробити термодинамічний аналіз процесів відновлення оксидів заліза воднем. Аналіз виконати за допомогою графіка впливу температури на рівновагу реакцій відновлення.
2.7. Викласти сутність металотермічного відновлення, область застосування.
2.8. Зробити термодинамічний аналіз процесів непрямого відновлення оксидів металів з різною спорідненістю до кисню.
2.9. Показати фізико-хімічну сутність металургійного відновлення: умови плину реакції убік відновлення, види металотермічного відновлення.
2.10. Зробити термодинамічний аналіз процесів відновлення оксидів заліза оксидом вуглецю й воднем. За результатами аналізу пояснити розходження в закономірностях процесів відновлення воднем й оксидом вуглецю.
Завдання до третього питання
3.1. Проаналізувати поводження домішок у сталеплавильній ванні залежно від їхньої спорідненості до кисню, показати вплив температури, основності шлаків на коефіцієнт розподілу домішок.
3.2. Розглянути форму існування кисню в металевій і шлаковій фазах. Залежність концентрації кисню в металі від окислювальної здатності шлаків.
3.3. Зробити термодинамічний аналіз реакцій окислювання марганцю в сталеплавильній ванні.
3.4. Зробити термодинамічний аналіз реакцій окислювання кремнію в сталеплавильній ванні
3.5. Зробити термодинамічний аналіз реакції окислювання вуглецю в сталеплавильній ванні.
3.6. Викласти сутність осаджуючого розкислення сталі: реакції розкислення, міри, спрямовані на зменшення забруднення сталі неметалічними включеннями. Утворення й видалення неметалічних включень у сталі при осаджуючому розкисленні.
3.7. Написати реакції десульфурації металу. Які фактори сприяють видаленню сірки з металу.
3.8. Розглянути вплив різних факторів (температури, тиску, складу металу) на розчинність азоту в металі, заходи боротьби з ним.
3.9. Розглянути реакції дефосфорації металу, проаналізувати основні фактори, що впливають на коефіцієнт розподілу фосфору.
3.10. Проаналізувати вплив температури, тиску газу, складу металу на розчинність водню в сталі. Заходи боротьби з воднем.
Завдання до четвертого питання
Розрахувати активність вуглецю в розплавленій сталі зазначеного складу при температурі 1600 0С
| мас.% | С | Si | Mn | Cr | Ni | Mo | V |
| 0,01× A | 0,2 | 0,3 | B | 0,3 |
де А - остання цифра, В - передостання цифра в заліковій книжці студента
Завдання до п’ятого питання
Розрахункові задачі п’ятого питання діляться на два блоки 5.1 й 5.2. Блок завдань в залежності від спеціальності визначається викладачем.
Блок 5.1
Визначити D G 0 заданої реакції й розрахувати константу рівноваги цієї реакції при температурі 1600 0С.
5.1.1 2[Al] + 3[O] =(Al2O3)
5.1.2. [Cr] + [N] =CrN
5.1.3. 2(FeO) + [Si] =Feж + (SiO2)
5.1.4. [Al] + [N] =AlN
5.1.5. [Ti] + [N] =TiN
5.1.6. 3[Mn] + [C] =Mn3C
5.1.7. [Si] + 2[O] =(SiO2)
5.1.8. (FeO) + [C] =Feж + CO
5.1.9. [Mn] + [O] = (MnO)
5.1.10. [Ti] + 2[O] = (TiO2)
Блок 5.2
5.2.1 Розрахувати рівноважний склад газової фази для реакції 3Fe2O3 + H2 = 2Fe3O4 + H2O при 900 0С, якщо lg Kp =813/ T + 3,894.
5.2.2 Розрахувати рівноважний склад газової фази для реакції Fe3O4 + H2 = 3Fe + H2O при 1000 0С, якщо lg Kp =-3760/ T + 3,850.
5.2.3 Розрахувати рівноважний склад газової фази для реакції 3Fe2O3 + CO = 2Fe3O4 + CO 2 при 800 0С, якщо lg Kp =2726/ T + 2,144.
5.2.4 Розрахувати рівноважний склад газової фази для реакції 3Fe2O3 + CO = 2Fe3O4 + CO 2 при 1000 0С, якщо lg Kp =2726/ T + 2,144.
5.2.5 Розрахувати рівноважний склад газової фази для реакції Fe3O4 + CO = 3Fe + CO2 при 900 0С, якщо lg Kp =-1850/ T + 2,100.
5.2.6 Розрахувати рівноважний склад газової фази для реакції FeО + CO = Fe + CO2 при 1100 0С, якщо lg Kp =688/ T -0,9.
5.2.7 Розрахувати мольну частку СаО у шлаці наступного складу (мас.,%): СаО = 30%, MgО =5%, FeО = 15%, SiО2 = 35%, MnО = 13,5%, P2O5= 1,5%.
5.2.8 Розрахувати мольну частку MgО у шлаці наступного складу (мас.,%): СаО = 30%, MgО =5%, FeО = 15%, SiО2 = 35%, MnО = 13,5%, P2O5= 1,5%.
5.2.9 Розрахувати мольну частку FeО в шлаці наступного складу (мас.,%): СаО = 35%, MgО =7%, FeО = 12%, SiО2 = 30%, MnО = 13%, P2O5= 3%.
5.2.10 Розрахувати мольну частку MnО в шлаці наступного складу (мас.,%): СаО = 35%, MgО =7%, FeО = 12%, SiО2 = 30%, MnО = 13%, P2O5= 3%.
Додаток 1
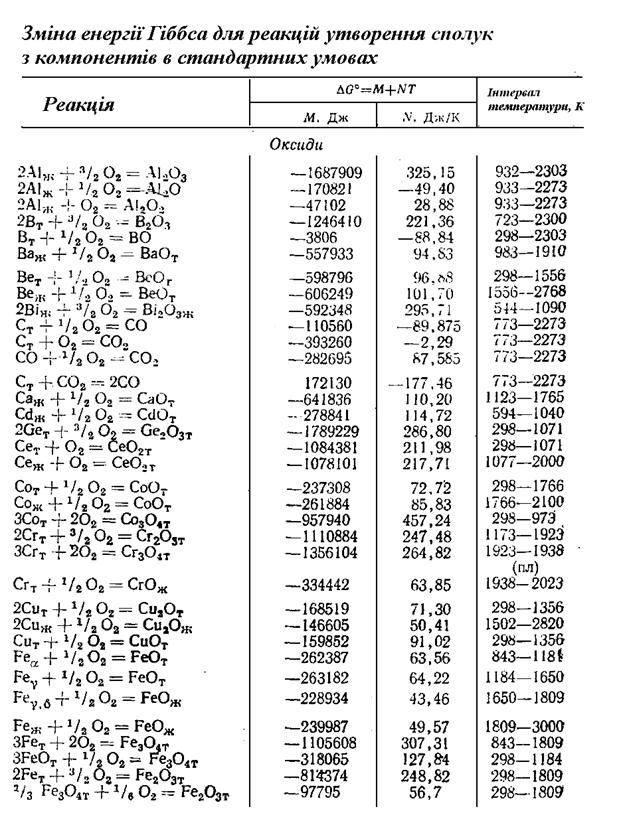
Продовження додатка 1
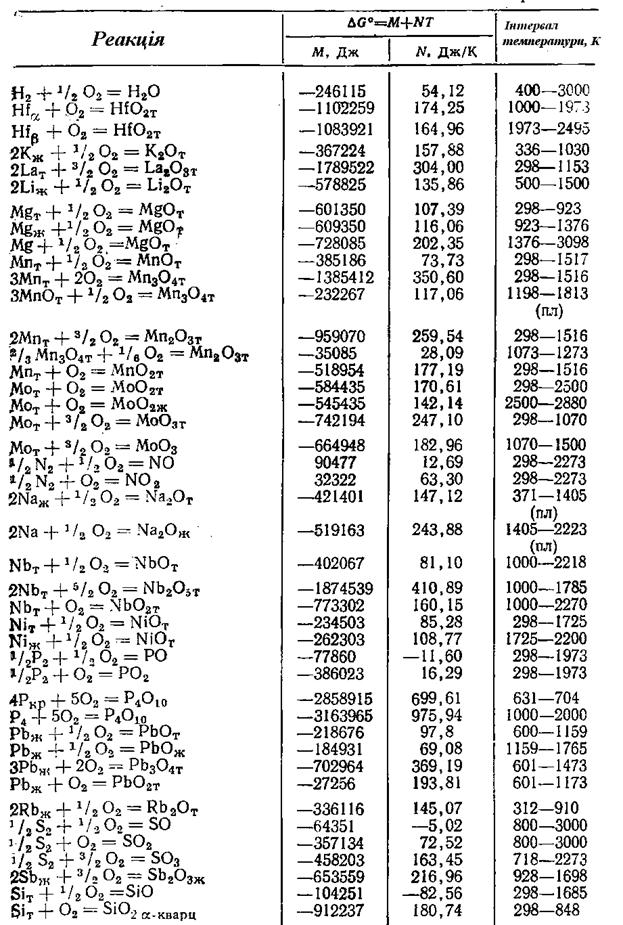
Продовження додатка 1

Продовження додатка 1
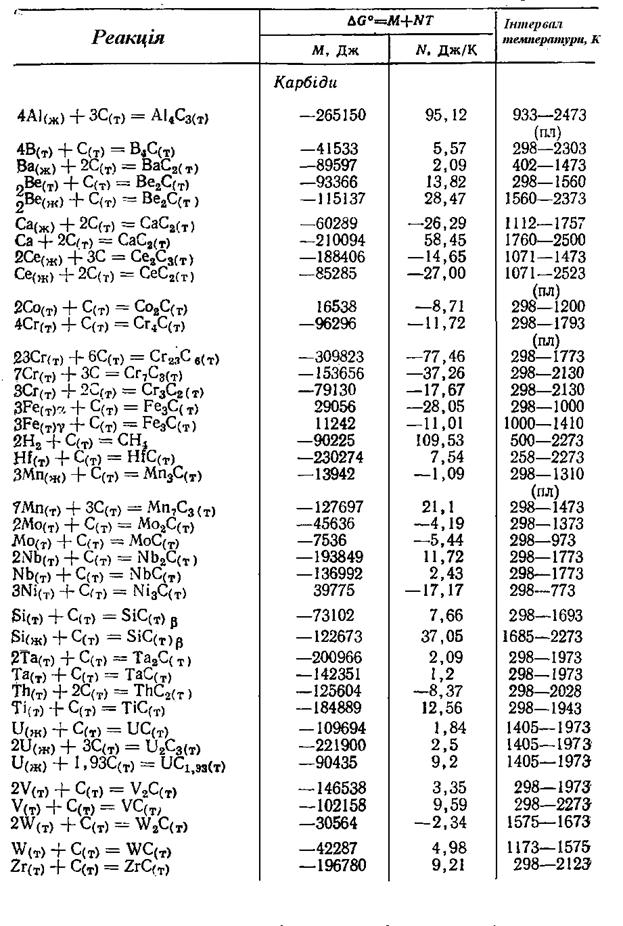
Продовження додатка 1
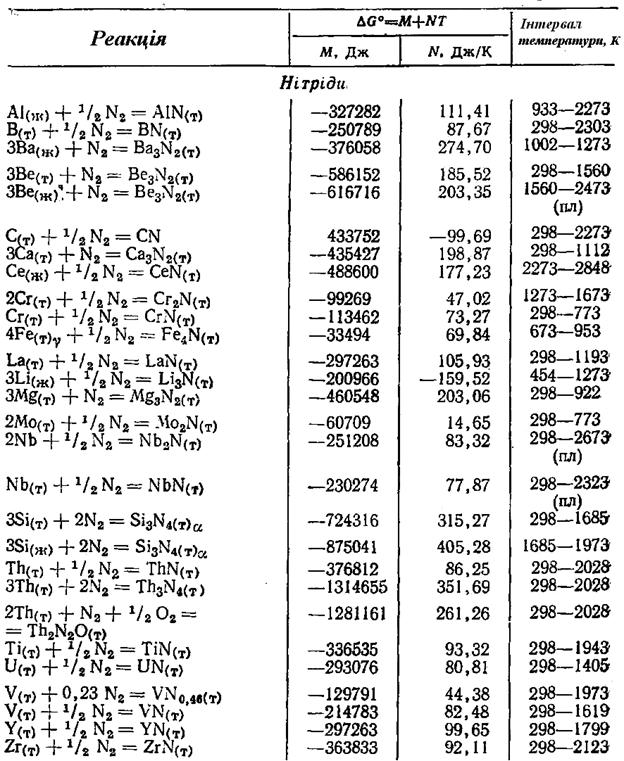
Додаток 2
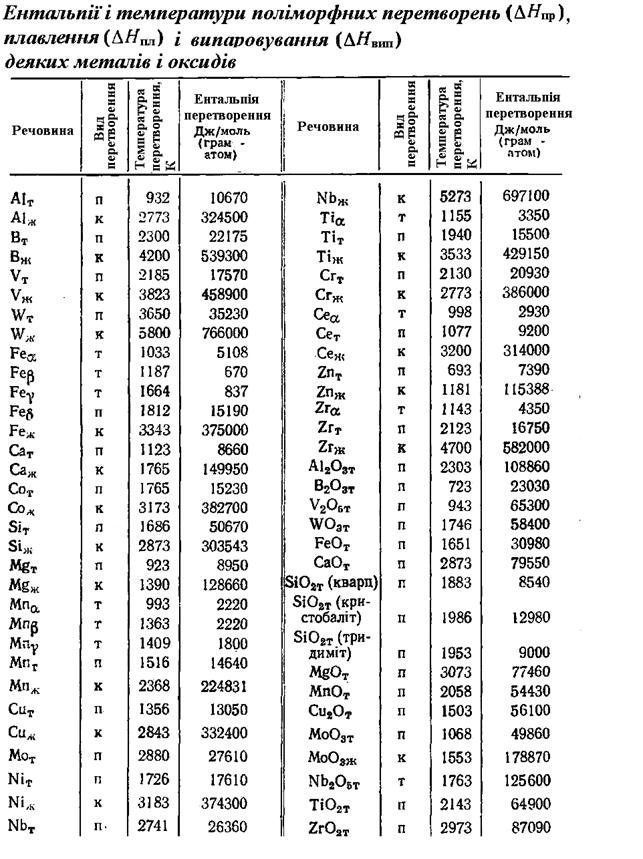
Додаток 3
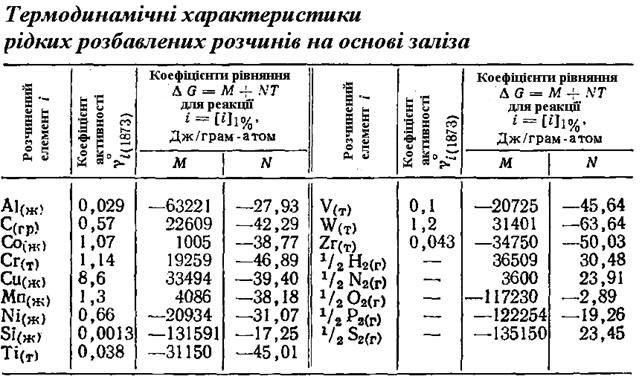
Додаток 4
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 406; Нарушение авторских прав?; Мы поможем в написании вашей работы!