
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні властивості розчинів. Виготовлення розчинів заданої концентрації
|
|
|
|
Лабораторна робота № 5
Мета: узагальнити теоретичні знання про розчини, формувати уміння виготовляти розчини заданої концентрації, удосконалювати уміння працювати з мірним посудом та зважувальними приладами.
Дослід 1. Зміна температури при розчиненні речовин.
В дві пробірки налити до 1/3 їх об’єму дистильованої води і виміряти її температуру. В першу пробірку насипати біля 1 г кристалічного амоній нітрату, розчинити його при перемішуванні і виміряйте температуру. В другу пробірку внести 2-3 шматочки лугу і після його розчинення визначити температуру розчину.
Зробіть висновок про тепловий ефект розчинення цих речовин.
Дослід 2. Залежність розчинності солей від температури.
В пробірку налити близько 1 мл води. Внести мікрошпатель натрій нітрату і перемішати до повного розчинення солі. Далі добавити NaNO3 і перемішувати до тих пір, поки на дні пробірки не залишиться трохи солі, яка не буде розчинятись при перемішуванні. Пробірку закріпити в пробіркотримачі і нагріти її в полум’ї до повного розчинення солі. Продовжувати додавати натрій нітрат в гарячий розчин до одержання насиченого розчину.
Нагріти пробірку до кипіння і повного розчинення кристалів солі, а потім охолодити пробірку в холодній воді. Спостерігати виділення кристалів NaNO3.
1. Дати визначення насиченим і ненасиченим розчинам.
2. Порівняти результати своїх спостережень з даними розчинності натрій нітрату.
3. Зробити висновок про залежність розчинності від температури.
Дослід 3. Виготовлення розчину солі з певною масовою часткою розчиненої речовини.
Варіант 1.
Виготовте 20 г розчину з масовою часткою калій хлориду 0,05.
Варіант 2.
Виготовте 25 г розчину з масовою часткою 3 %.
Варіант 3.
Виготовте 15 г розчину з масовою часткою натрій карбонату 3 %.
Варіант 4.
Виготовте 20 г розчину з масовою часткою кухонної солі 15 %.
Відповідно до завдання, яке видав викладач (можливі також і інші завдання), обчисліть, яку масу солі і води треба взяти для виготовлення розчину.
Зважте на аналітичних терезах відповідно до зроблених обчислень масу солі (наважку) та висипте сіль у хімічний стакан.
Відміряйте мірним циліндром потрібний об’єм дистильованої води і вилийте в хімічний стакан з наважкою. Перемішайте вміст стакана скляною паличкою до повного розчинення солі.
Дослід 4. Виготовлення розчину солі заданої молярної концентрації.
Варіант 1.
Виготовте 25 мл розчину калій хлориду з молярною концентрацією 0,2 моль/л.
Варіант 2.
Виготовте 25 мл розчину натрій нітрату з молярною концентрацією 1 моль/л.
Варіант 3.
Виготовте 25 мл розчину натрій карбонату з молярною концентрацією 0,15 моль/л.
Відповідно до завдання, яке видав викладач (можливі і інші варіанти), обчисліть масу солі, необхідну для виготовлення заданого об’єму розчину.
Зважте на аналітичних терезах відповідно до зроблених обчислень наважку солі.
Всипте зважену сіль у мірну колбу на 25 мл. Для цього вставте у мірну колбу суху лійку і через неї всипте наважку солі, а потім ретельно змийте стінки лійки невеликим об’ємом дистильованої води з промивалки.
Добавте в мірну колбу дистильовану воду до 1/3 її місткості (приблизно 7-10 мл). Закрийте колбу щільно пробкою, перемішайте її вміст обережним струшуванням, домагаючись повного розчинення солі. Якщо сіль не розчинилась, добавте ще води, але не більше ¾ місткості колби. Після того, як сіль розчиниться, долийте води до риски (останню краплю добавте з піпетки) так, щоб нижній рівень меніска співпадав з мірною рискою. Закрийте колбу пробкою і знову перемішайте.
Дослід 5. Виготовлення розчину заданої концентрації з проведенням розрахунків за діагональними схемами.
В лабораторній практиці часто виникає необхідність із концентрованого розчину виготувати розведений. Для розрахунку зручно користуватись правилом діагональних схем (правило «хреста»"):
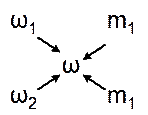 де ω – масова частка заданого розчину; ω1 – масова частка розчину з вищою концентрацією; ω2 – масова частка розчину, який використовується для розведення (у випадку з водою ω2 = 0); m1 i m2 – маси вихідних розчинів, які визначають співвідношення, в яких необхідно змішувати вихідні розчини: m1 = ω-ω2 i m2 = ω1-ω.
де ω – масова частка заданого розчину; ω1 – масова частка розчину з вищою концентрацією; ω2 – масова частка розчину, який використовується для розведення (у випадку з водою ω2 = 0); m1 i m2 – маси вихідних розчинів, які визначають співвідношення, в яких необхідно змішувати вихідні розчини: m1 = ω-ω2 i m2 = ω1-ω.
Наприклад, треба приготувати 100 см3 10 %-го розчину кухонної солі із 22 % і 4 %-го розчинів NaCl.
Скористаємось правилом діагональних схем:
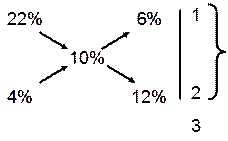
| співвідношення масових частин 22%-го і 4%-го розчину - сума їх масових частин. |
Із довідника виписуємо значення густини розчинів кухонної солі з різною масовою часткою: ρ22% = 1,164 г/см3, ρ10% = 1,071 г/см3; ρ4% = 1,027 г/см3.
Знаходимо масу 100 см3 10 %-го розчину солі: m = V · ρ; m = 100 см3 · 1,071 г/см3 = 107,1 г.
Ще раз згадуємо, що маса 22 %-го розчину у виготовленому розчині складає одну частину, а 4 %-го – дві. Знаходимо маси цих розчинів, склавши пропорції:
| 107,1 | - | 3 ч | 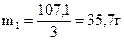
|
| m1 | - | 1 ч |
| 107,1 | - | 3 ч | 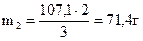
| ||||
| m2 | - | 2 ч | |||||
Розраховуємо відповідні об’єми, розділивши масу розчину на його густину:
V22% = 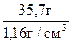
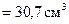 ; V4% =
; V4% = 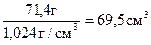
Зазначимо, що якщо розчини, які змішуються, мають різну густину, то додавати їх об’єми при розрахунках не можна (так званий об’ємний ефект).
Виміряти розраховані об’єми вихідних розчинів, змішати їх у склянці місткістю 200 см3 і добре перемішати. Перенести добутий розчин у мірний циліндр на 100 см3 і визначити його густину ареометром. Порівняти це значення з табличним та розрахувати відносну похибку.
Завдання та запитання для самопідготовки
1. Для хвойної ванни, що дає змогу зняти втому, головний біль, поліпшити настрій, у воді об’ємом 200 л розчиняють порошкоподібний хвойний екстракт масою 60 г. Яка масова частка хвойного екстракту в розчині?
2. Для миття обладнання у харчовій промисловості використовують 10%-й розчин натрій карбонату (кальцинованої соди). Визначте масу соди, яку необхідно взяти для приготування 10 л такого розчину. Густина розчину 1,1 г/см3.
3. Змішали 1 кг молока із жирністю 3% із 500 г молока, що має жирність 2%. Визначте жирність (%) одержаного молока.
4. Визначити, яку масу води треба додати до 2 кг 50%-го розчину цукру, щоб одержати 10%-й розчин.
5. Для одержання розсолу змішали 30 см3 22% розчину солі (густина 1,64 г/см3) і 70 см3 4% розчину (густина 1,03 г/см3). Визначте масову частку (у %) NaCl у добутому розчині та молярну концентрацію цього розчину, якщо його густина 1,17 г/см3.
6. Розчинність KNO3 при 10 0С становить 20 г. 500 г 60%-го гарячого розчину KNO3 охолодили до 10 0С. Яка маса KNO3 викристалізувалась?
7. Обчисліть масу калій гідроксиду, необхідну для виготовлення розчину з концентрацією 0,5 моль/л КОН, об’єм якого 250 см3.
8. У 2 л етанолу (густина 0,79 г/см3) за н. у. розчинили 4 л сірководню. Обчисліть масову частку H2S в добутому розчині.
9. Який об’єм в см3 розчину сульфатної кислоти з масовою часткою речовини 80% та густиною 1,732 г/см3 треба взяти для приготування 2 л 6 М розчину H2SO4?
10. До 800 мл 3 н. розчину КОН додали 1,2 л розчину з масовою часткою калій гідроксиду 12% та густиною 1,1 г/см3. Чому дорівнює молярна концентрація еквівалентів речовини у розчині? Зміною об’єму при змішуванні розчинів знехтувати.
11. Визначте масову частку хлороводню в 11,8 н. розчині НС1 з густиною 1,18 г/см3.
12. Обчисліть осмотичний тиск розчину, в 1 л якого при 21 0С розчинено 3,1 г аніліну.
13. При 42 0С пружність водяної пари дорівнює 8199 Па. На скільки зменшиться пружність водяної пари при цій самій температурі, якщо в 540 г води розчинили 36 г глюкози С6Н12О6?
14. При якій температурі закипить розчин цукру С12Н22О11 з масовою часткою речовини 50% (ебуліоскопічна константа води дорівнює 0,52)?
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 901; Нарушение авторских прав?; Мы поможем в написании вашей работы!