
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод електронного балансу
|
|
|
|
ВСТУП
Мета методичних вказівок – допомогти студентам у самостійній роботі над вивченням теми про окисно-відновні процеси та реакції. Окисно-відновні реакції – одне з найважливіших теоретичних питань основних розділів загальної, неорганічної, органічної, аналітичної та фізичної хімії.
Окисно-відновні реакції надзвичайно поширені у природі: процеси фотосинтезу, дихання, травлення, підтримування життєдіяльності біологічних систем. Ці реакції відіграють важливу роль у практичній діяльності людини (вилучення металів і неметалів з руд, використання хімічних джерел струму, синтез хімічних продуктів, боротьба з корозією металів і т.п.).
Методичні вказівки дають можливість студентам засвоїти такі поняття, як ступінь окиснення елементів, окисник, відновник, процеси окиснення, відновлення та набудуть практичних навичок методами електронного та іонно-електронного балансів, визначати коефіцієнти в рівняннях окисно-відновних реакцій.
1. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
1.1. Ступінь окиснення елементів
У багатьох хімічних реакціях утворення речовин відбувається в результаті переміщення електронів від одних частинок до інших. Залежно від ступеня зміщення електронів виникають сполуки різного характеру: від іонного до ковалентно-неполярного. Для характеристики стану електронів у хімічних сполуках впроваджено поняття ступеня окиснення.
Ступенем окиснення елемента називається формальний заряд, який визначається числом електронів, зміщених від атома або до атома даного елемента у сполуці.
Позитивний ступінь окиснення означає число електронів, що зміщується від даного атома, а негативний – до даного атома.
З цього витікає, що у сполуках з неполярним зв'язком ступінь окиснення елементів дорівнює нулю.
У простих іонних сполуках ступінь окиснення елементів відповідає електричному заряду (заряду іона), оскільки при утворенні цих сполук відбувається практично повний перехід електронів від одного атома до іншого. У сполуках з полярними ковалентними зв'язками ступінь окиснення визначається величиною електронегативності. Елементи з більшою електронегативністю мають негативний ступінь окиснення, а з меншою – позитивний.
Необхідно запам'ятати випадки, коли елементи мають постійний ступінь окиснення.
Ступінь окиснення елемента у простій сполуці і в елементарному стані дорівнює нулю: 
У молекулах складних речовин ступінь окиснення Гідрогену (окрім гідридів металів) дорівнює +1, а Оксигену −2:  Ступінь окиснення елементів головних підгруп І, II і III груп періодичної системи у сполуках завжди позитивний і дорівнює номеру групи:
Ступінь окиснення елементів головних підгруп І, II і III груп періодичної системи у сполуках завжди позитивний і дорівнює номеру групи: 
У сполуках з металами і Гідрогеном ступінь окиснення галогенів F, Сl, Вr, І дорівнює −1, Сульфуру –2: 
У сполуках з Оксигеном максимальний позитивний ступінь окиснення Сульфуру, Фосфору, Нітроґену, Хлору дорівнює номеру групи: 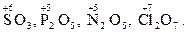
Ступінь окиснення металів у сполуках з Сульфуром, галогенамитаіншими неметалами відповідає заряду іона металу:
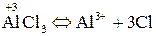 ¯.
¯.
Слід мати на увазі, що, позначаючи ступінь окиснення, спочатку ставлять знак, а після нього – число. Заряд іона записують зворотним порядком: спочатку ставлять число, а потім – знак. При цьому ступінь окиснення пишуть над символом елемента, а заряд іона – праворуч від нього.
Більшість елементів може виявляти різний ступінь окиснення у сполуках. При його визначенні користуються правилом, згідно з яким сума ступенів
окиснення в електронейтральних молекулах дорівнює нулю, а у складних іонах – заряду цих іонів.
1.2. Поняття про окисно-відновні реакції
Усі хімічні реакції можна розподілити на дві групи. У реакціях першої групи ступінь окиснення всіх елементів, що входять до складу речовин, залишається незмінним, а у реакціях другої групи – змінюється.
Як приклад реакцій першої групи можна навести реакцію розчинів
електролітів
 . (1)
. (1)
Прикладом реакцій другої групи може служити взаємодія цинку з купрум (ІІ) сульфуром:
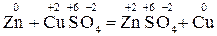 . (2)
. (2)
Якщо в реакції (І) жоден елемент не змінює ступеня окиснення, то у
прикладі (2) ступінь окиснення Цинку змінюється від 0 до +2, а Купруму – від +2 до 0.
Реакції, у результаті яких змінюються ступені окиснення елементів, називаються окисно-відновними.
Слід звернути увагу на те, що окисно-відновні процеси надзвичайно поширені у природі (засвоєння вуглекислого газу рослинами, корозія металів та ін.) і відіграють важливу роль у практичній діяльності людини (вилучення металів і неметалів з руд, використання хімічних джерел струму, боротьба з корозією, виробництво хімічних продуктів і т.п.).
З електронної точки зору окисно-відновний процес пов'язаний з переміщенням електронів від одних частинок (атомів, молекул, іонів) до інших. Так, у наведеній реакції (2) електрони від атомів Цинку переходять до іонів Купруму:
 – 2
– 2  =
=  – окиснення, відновник Zn;
– окиснення, відновник Zn;
(3)
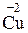 + 2
+ 2  =
= 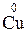 – відновлення, окисник CuSO4;
– відновлення, окисник CuSO4;

 +
+ 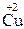 =
=  +
+ 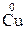 .
.
Процес втрати частинок електронів називається окисненням, а процес приєднання електронів до частинки – відновленням. Отже, у розглянутій
реакції (2) цинк окиснюється, а іон купруму – відновлюється. У реакції ці обидва процеси протікають одночасно.
Речовина, до складу якої входить елемент, що окиснюється (тобто елемент, який втрачає електрони), називається відновником, а речовина, яка містить елемент, що відновлюється (тобто елемент, який приєднує електрони) – окисником.
У наведеному прикладі CuSO4 – окисник, а Zn – відновник.
З рівняння (3) видно, що атом цинку втрачає, а іон купруму приєднує два електрони.
Таким чином, при окисно-відновних реакціях загальне число електронів, що віддає відновник, повинно дорівнювати загальному числу електронів, що приєднує окисник. На цій підставі засновано існуючі методи визначення коефіцієнтів у окисно-відновних реакціях: електронного балансу та іонно-електронний.
Контрольні питання та завдання
1. Чим визначається позитивний та негативний ступені окислення елементів?
2. Чому дорівнює сума ступенів окиснення елементів у молекулах сполук?
3. Визначте ступені окиснення елементів у молекулах таких сполук:
HNO3, BaCL2, Cr2(SO4)3, (AlOH)3(PO4)2.
4. Які реакції називаються окисно-відновними?
5. Які процеси відбуваються під час окиснення та відновлення частинок?
2. СКЛАДАННЯ РІВНЯНЬ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ
Для запису рівняння окисно-відновної реакції треба знати властивості
взаємодіючих речовин. Питання про продукти реакції може бути вирішено
експериментально. Наприклад, при взаємодії сірководню з калій дихроматом у кислому середовищі колір розчину змінюється з оранжевого на зелений, характерний для сполук тривалентного хрому, крім того, розчин мутніє внаслідок випадання в осад сірки.
Запис вихідних речовин і продуктів реакції виглядає так:
 . (4)
. (4)
У тому разі, коли відомі вихідні і кінцеві продукти реакції, визначення коефіцієнтів у рівнянні цієї реакції відбувається задопомогою методу електронного балансу. Для його успішного засвоєння необхідно знати таку послідовність дій:
1. Визначають ступінь окиснення елементів у речовинах лівої і правої частин рівняння:
 (5)
(5)
Позначають елементи, ступінь окиснення яких у ході реакції змінився. У нашому випадку такими елементами є Хром і Сульфур.
2. Складають рівняння електронного балансу з урахуванням загального числа атомів, які окиснилися і відновилися. У К2Сr2О7 (окисник) два атоми Хрому приєднують 6 електронів (відновлення), а у Н2S (відновник) атом Сульфуру втрачає 2 електрони (окиснення):


 2
2 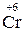 + 6
+ 6  = 2
= 2  6 1 – відновлення, окисник K2 Cr2 O7;
6 1 – відновлення, окисник K2 Cr2 O7;
6 (6)
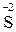 – 2
– 2  =
=  2 3 – окиснення, відновник H2S.
2 3 – окиснення, відновник H2S.


 2
2 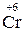 + 6
+ 6  + 3
+ 3 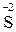 - 6
- 6  = 2
= 2  + 3
+ 3  . (7)
. (7)
Виходячи з того, що число електронів, яке віддає відновник, повинно дорівнювати числу електронів, отриманих окисником, за правилом найменшого загального кратного визначають у рівнянні реакції основні коефіцієнти для відновника (3) і окисника (1), які у подальшому в багатьох випадках залишаються незмінними.
Помноживши перше рівняння на коефіцієнт (1), а друге – на (3), знаходять загальне рівняння (7) як суму перших двох. Вірність цього рівняння перевіряють за рівністю обох його частин:
– кількості відданих та приєднаних електронів (6  );
);
– кількості однойменних атомів (2Cr, 3S);
– сум ступенів окиснення: + 12 – 6 = + 6 + 0 → + 6 = + 6.
3. Переносять знайдені коефіцієнти перед Cr та S у вихідне рівняння з урахуванням числа атомів, що входять до складу відповідних молекул речовин:
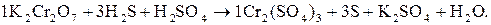 (8)
(8)
4. Далі перевіряють число атомів металів, що не змінюють ступінь окиснення (Калію), кислотних залишків (груп  ) і встановлюють коефіцієнти для K2SO4 (1) і H2SO4 (4).
) і встановлюють коефіцієнти для K2SO4 (1) і H2SO4 (4).
5. За числом атомів гідрогену у вихідних речовинах (14) знаходять число молекул води, що утворилися (7), і записують рівняння реакції в остаточному вигляді:
 (9)
(9)
6. Правильність визначення коефіцієнтів у рівнянні реакції перевіряють по числу атомів Оксигену в обох його частинах (23).
Наведена вище методика складання рівнянь може бути застосована до
більшості окисно-відновних реакцій. Проте існують спеціальні випадки, що
потребують додаткових пояснень.
2.2. Окремі випадки складання рівнянь
окисно-відновних реакцій
Розглянутий вище приклад належить до типу міжмолекулярних реакцій, у яких окисник, відновник і середовище являють собою різні речовини. Серед подібного типу зустрічаються такі, у яких окисник або відновник одночасно є і середовищем. Наприклад, реакція взаємодії калій перманґанату з концентрованою хлоридною кислотою:
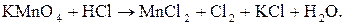 (10)
(10)
Оскільки НСІ є одночасно і відновником, і середовищем, у якому протікає процес, то у рівнянні реакції доцільно формулу хлоридної кислоти записати двічі:
 (11)
(11)


 + 5
+ 5  =
= 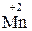 2 – відновлення, окисник KMnO4;
2 – відновлення, окисник KMnO4;
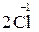 – 2
– 2  =
=  5 – окислення, відновник HCl;
5 – окислення, відновник HCl;
 |
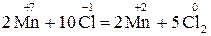 .
.
За числом атомів Калію у КМnО4 знаходять число молекул КСІ (2), а за числом атомів Хлору (6) у правій частині, що не змінили ступеня окиснення, – коефіцієнт перед НСІ-середовищем (6):
 (12)
(12)
Визначають число молекул води (8) і остаточно записують рівняння:
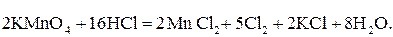 (13)
(13)
До внутрішньомолекулярних реакцій належать такі, у яких змінюються ступені окиснення атомів у одній і тій самій молекулі. Наприклад, це реакції термічного розкладу:
 . (14)
. (14)


 – 4
– 4  =
=  4 3 – окиснення, відновник KClO3;
4 3 – окиснення, відновник KClO3;
 + 6
+ 6  =
=  6 2 – відновлення, окисник KClO3;
6 2 – відновлення, окисник KClO3;
 |
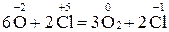 .
.
У реакціях диспропорціювання (самоокиснення – самовідновлення ) відбувається збільшення і зменшення ступеня окиснення одного й того елемента:
 . (15)
. (15)


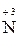 – 2
– 2  =
=  2 1 – окиснення, відновник HNO2;
2 1 – окиснення, відновник HNO2;
 +
+  =
= 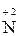 1 2 – відновлення, окисник HNO2;
1 2 – відновлення, окисник HNO2;

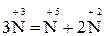 .
.
2.3. Складні окисно-відновні реакції
Трапляються особливі випадки добору коефіцієнтів в рівняннях окисно-відновних реакцій, в яких ступень окиснення змінюють не два, як в багатьох випадках, а три елементи. У цьому разі дотримуються такої послідовності дій:
1. Визначають ступені окиснення елементів, що входять до складу сполук у обох частинах рівняння окисно-відновної реакції, та виділяють елементи, ступені окиснення яких змінюються:
 . (16)
. (16)
2. Складають рівняння напівреакцій окиснення і відновлення:
2  – 4
– 4  = 2
= 2  – окиснення
– окиснення
3 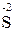 – 24
– 24  = 3
= 3 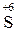 – окиснення (17)
– окиснення (17)
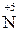 + 3
+ 3  =
=  – відновлення
– відновлення
3. Підсумовують перше та друге рівняння окиснення  та
та 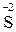 :
:
2  +3
+3 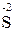 – 28
– 28  = 2
= 2  + 3
+ 3 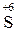 . (18)
. (18)
4. Об'єднують рівняння (18) з рівнянням відновлення 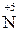 і далі методом електронного балансу визначають коефіцієнти:
і далі методом електронного балансу визначають коефіцієнти:


 2
2  +3
+3 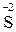 – 28
– 28  = 2
= 2  + 3
+ 3 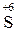 28 3 – окиснення, відновник
28 3 – окиснення, відновник 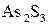 ;
;
84 (19)
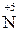 + 3
+ 3  =
=  3 28 – відновлення, окисник
3 28 – відновлення, окисник 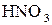 ;
;
 |
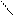
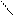
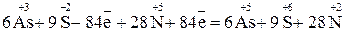 . (20)
. (20)
5. Переносять знайдені коефіцієнти у вихідне молекулярне рівняння з урахуванням числа атомів в молекулах речовин:
 . (21)
. (21)
6. За кількістю атомів Гідрогену, яке дорівнює 36 у правій частині рівняння, знаходять, що число молекул води у лівій частині дорівнює 4:
 . (22)
. (22)
7. Правильність визначення коефіцієнтів перевіряють за рівністю атомів Оксигену, що дорівнює 88 у обох частинах рівняння окисно-відновної реакції.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 696; Нарушение авторских прав?; Мы поможем в написании вашей работы!