
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбционная очистка газов 2 страница
|
|
|
|
Кажущаяся плотность ρк выражает массу гранулы адсорбента, отнесенную к ее объему. Насыпная плотность ρн гранул адсорбента выражает массу единицы объема их слоя. Насыпная и кажущаяся плотности связаны с пористостью (порозностью) слоя адсорбента ε, выражающей долю свободного объема слоя, соотношением:
ρн = (1 – ε) ρк. (97)
Следовательно,
ε = 1 – ρн/ρк. (98
Аналогичное выражение определяет пористость ε' гранул: (зерен) адсорбента:
ε' = 1 – ρк /ρи, (99)
где ρи – истинная плотность адсорбента, кг/м3.
Величину пористости слоя определяют форма гранул адсорбента и характер их расположения (упаковки) в слое. Форма гранул промышленных адсорбентов обычно не является шаровидной, поэтому в соответствующих расчетах используют величину эквивалентного диаметра d э:
d э = 6/ Sv.. (100)
где Sv – удельная геометрическая поверхность единицы объема, представляющая отношение величины поверхности гранул к их объему V.
На практике в качестве адсорбентов выгодно использовать вещества с развитой удельной (на единицу объема) поверхностью. Поэтому промышленные адсорбенты изготавливают из твердых пористых материалов с высокоразвитой внутренней поверхностью, их используют в раздробленном, гранулированном или порошкообразном виде. Эти материалы могут иметь синтетическое или природное происхождение.
ВОПРОС 44Основные типы адсорбентов. К основным типам промышленных адсорбентов относятся активные угли, силикагели, алюмогели (активный оксид алюминия), цеолиты и иониты.
Основными источниками для получения активированного угля являются скорлупа кокосового и других видов орехов, фруктовые косточки, битуминозные угли, твердая древесина, а также кокс и остатки процесса нефтепереработки.
Активные угли характеризуются гидрофобностью (плохой сорбируемостью полярных веществ, к которым принадлежит и вода). Это свойство определяет широкое их использование в практике рекуперационной и санитарной очистки отходящих газов разнообразной влажности. Для адсорбции газов и паров используют микропористые гранулированные активные угли. С этой целью промышленность выпускает следующие марки газовых и рекуперационных активных углей: АГ-2, СКТ, АР, СКТ-3, APT. Угли АГ-2 предназначены для адсорбции газов, уголь
СКТ – для улавливания паров органических веществ, угли АР, СКТ-3 и APT – для очистки газов от паров летучих растворителей.
В состав активированного угляв основном входят нейтральные атомы, и электрический градиент между молекулами отсутствует. В связи с этим здесь нет градиента потенциалов, позволяющего притягивать и ориентировать полярные молекулы более эффективно, чем неполярные. Таким образом, уголь является и эффективным адсорбентом для улавливания органических соединений из влажных газовых потоков. Поскольку взаимное притяжение полярных молекул воды столь же сильно, как и их притяжение к поверхности нейтрального угля, селективность адсорбента в отношении органических молекул несколько повышается.Однако некоторое количество воды также адсорбируется, особенно если парциальное давление ее паров выше, чем паров органического вещества; в этом случае адсорбцию воды следует учитывать при проектировании. Уголь обладает меньшей селективностью, чем другие сорбенты, и является одним из немногих пригодных для работы во влажных газовых потоках.
Активные угли для газоочистки характеризуются объемом микропор в пределах 0,24–0,48 см3/г при суммарном объеме пор 0,52–
1,00 см3/г, гравиметрическая плотность их гранул составляет 0,3–
0,6 г/см3, удельная поверхность – 400–1500 м2/г. Активные угли производят в виде цилиндрических гранул диаметром 1–6 мм и длиной, обычно превосходящей поперечный размер гранул, и чаще всего применяют в виде стационарного слоя, через который фильтруют подлежащий очистке газовый поток. Существенными недостатками активных углей являются относительно невысокая механическая прочность и горючесть. Значительный интерес применительно к решению задач газоочистки в последнее время вызывают такие нетрадиционные углеродные адсорбенты, как активные угли из полимерных материалов, молекулярно-ситовые активные угли и активированные углеродные волокна.
Производимые из полимерных материалов активные угли характеризуются развитой системой микропор с диаметром (1–1,5)·10–9 м и более регулярной структурой. Это обеспечивает определенное улучшение прочностных характеристик и повышенную адсорбционную активность при низком содержании целевых компонентов в очищаемых газах.
Молекулярно-ситовые активные угли отличаются высокой однородностью микропористой структуры и обладают микропорами еще более узких размеров [(0,4–0,7) 10–9 м], имеющих тот же порядок, что и размеры молекул. Перспективным направлением их использования полагают очистку влажных газов.
Активированные углеродные волокна представляют собой изготовляемые из синтетических волокон микропористые адсорбенты с широкой гаммой физических форм продукции на их основе (путанка, нетканые изделия, войлок, ткань и другие материалы). Это обеспечивает разнообразность аппаратурного оформления соответствующих процессов газоочистки. Наряду с высокой термохимической стойкостью и хорошими поглотительными и фильтрующими свойствами волокнистые углеродные адсорбенты характеризуются повышенными скоростями адсорбционно-десорбционных процессов. Это объясняется весьма малыми диаметрами их волокон, составляющих (0,6–1,0)·10–5 м.
Оксидные адсорбенты характеризуются негомогенным распределением заряда, они полярны. Эти адсорбенты обладают значительно более высокой селективностью, чем уголь, по отношению к полярным молекулам. Их недостатком является снижение эффективности в присутствии влаги. Большинство из этих адсорбентов – прекрасные осушители.
К классу кремнийсодержащих адсорбентов относятся такие оксидные адсорбенты, как силикагели, отбеливающие и диатомитовые земли, синтетические цеолиты, или молекулярные сита. Их адсорбционная способность изменяется в весьма широком интервале, причем максимальные значения близки к величинам, характерным для активированного угля.


 Силикагели по своей химической природе представляют собой гидратированные аморфные кремнеземы (SiO2· n H2O), являющиеся реакционно способными соединениями переменного состава, превращения которых происходят по механизму поликонденсации:
Силикагели по своей химической природе представляют собой гидратированные аморфные кремнеземы (SiO2· n H2O), являющиеся реакционно способными соединениями переменного состава, превращения которых происходят по механизму поликонденсации:
n Si(OH)4 → Si n 0 2n-m +(2n – m)Н2О.
Поликонденсация ведет к формированию структурной сетки, образованной сфероподобными частицами коллоидных размеров (2∙10–9– 2∙10–8 м), которая сохраняется при высушивании гидрогеля кремневой кислоты и образует жесткий кремнекислородный каркас. Зазоры между частицами создают пористую структуру силикагеля.
Для получения силикагелей в промышленности обычно используют метод осаждения аморфного кремнезема из силикатов щелочных металлов минеральными кислотами. Выпускают силикагель в виде шариков, таблеток или кусочков неправильной формы. Размеры их зерен составляют 0,1–7,0 мм. Адсорбционные и химические свойства силикагелей существенно зависят от наличия на их поверхности групп ≡Si–ОН.
По характеру пористой структуры силикагели классифицируют на крупно-, средне- и мелкопористые. К ним относят кусковые и гранулированные материалы, характеризующиеся средним радиусом пор, составляющим соответственно 5∙10–9, (5–1,5) 10–9 и (1,5–1,0)∙10–9 м.
По размеру зерен кусковые силикагели широкого использования делят на 4 марки (7,0–2,7; 3,5–1,5; 2,0–0,25; 0,5–0,2 мм), а гранулированные – на 2 марки (7,0–2,7 и 3,5–1,0 мм). Для их обозначения используют буквенные сочетания: КСК – крупный силикагель крупнопористый, КСС – крупный силикагель среднепористый, МСМ – мелкий силикагель мелкопористый и т. п. Средние фракции силикагелей называют шихтой и обозначают соответственно как ШСК, ШСС и ШСМ. Гранулированный мелкопористый силикагель содержит 4–10% А12О3 в качестве добавки, предупреждающей растрескивание его гранул.
Объем пор силикагелей составляет 0,3–1,2 см3/г, их удельная поверхность находится в пределах 300–750 м2/г, а гравиметрическая плотность заключена в интервале 0,4–0,9 г/см3. Последний показатель может служить косвенной характеристикой пористой структуры силикагелей: для мелкопористых силикагелей он составляет 0,7–0,8 г/см3, а для крупнопористых – 0,4–0,5 г/см3.
Силикагели служат для поглощения полярных веществ. Мелкопористые силикагели используют для адсорбции легко конденсируемых паров и газов, крупнопористые и частично среднепористые силикагели служат эффективными поглотителями паров органических соединений. Высокое сродство поверхности силикагелей к парам воды обусловливает широкое их использование в качестве агентов осушки разнообразных газовых сред. Силикагели негорючи, характеризуются низкой температурой регенерации (110…200°С) и достаточно высокой механической прочностью. В то же время они разрушаются под действием капельной влаги, что необходимо учитывать при их использовании в системах газоочистки.
Активный оксид алюминия получают прокаливанием различных гидроксидов алюминия. Основные марки выпускаемого отечественной промышленностью активного оксида алюминия представляют собой цилиндрические гранулы диаметром 2,5–5,0 мм и длиной 3–7 мм, а также шариковые гранулы со средним диаметром 3–4 мм. Удельная поверхность алюмогелей составляет 170–220 м2/г, суммарный объем пор находится в пределах 0,6–1,0 см2/г, радиус пор и гравиметрическая плотность гранул цилиндрической и шаровидной формы составляют соответственно (6–10)∙10–9 и (3–4)∙10–9 м и 500–700 и 600–900 кг/м3. В отличие от силикагелей, алюмогели стойки к воздействию капельной влаги. Их используют для улавливания полярных органических соединений и осушки газов.
Цеолиты представляют собой алюмосиликаты, содержащие в своем составе оксиды щелочных и щелочноземельных металлов, и характеризующиеся регулярной структурой пор, размеры которых соизмеримы с размерами молекул. Это определило и другое их название – «молекулярные сита».
Химическая формула цеолитов Me2/ n O∙Al2O3∙ x Si02∙ y H2O, где Me – катион щелочного металла, n – его валентность. Кристаллическая структура (алюмосиликатный скелет) цеолитов образована тетраэдрами SiO4 и А1О4, их избыточный отрицательный заряд компенсирован положительным зарядом катионов соответствующих металлов. Катионы цеолитов в определенных условиях их обработки могут замещаться на соответствующие катионы контактируемых с ними растворов, что позволяет рассматривать цеолиты как катионообменники. Поглощение вещества происходит в адсорбционных полостях цеолитов, соединяющихся друг с другом входными окнами строго определенных размеров. Проникать через окна могут лишь те молекулы, критический диаметр которых (диаметр по наименьшей оси молекулы) меньше диаметра входного окна.
Цеолиты получают синтетическим путем и добывают при разработке природных месторождений. Среди многих десятков различных синтетических цеолитов в решении задач газоочистки в основном используют производимые в промышленных масштабах цеолиты общего назначения марок NaA, СаХ, NaX, характеризующиеся диаметром входного окна, составляют ангстремах (1A = 10–9 м) соответственно 4, 5, 8 и 9. Первый индекс марки цеолита характеризует его обменный катион. Второй индекс обозначает тип кристаллической решетки цеолита – А или X, причем цеолиты с решеткой типа X характеризуются входными окнами большего размера, чем цеолиты с решеткой типа А. Синтетические цеолиты выпускаются промышленностью в виде цилиндрических и шарообразных гранул, диаметр которых составляет 2–5 мм, производимых с применением связующего материала (10–20% глины) или без него
(в последнем случае механическая прочность гранул выше).
Цеолиты обладают наибольшей адсорбционной способностью по отношению к парам полярных веществ и соединений с кратными связями в молекулах. Однако по сравнению с другими типами промышленных адсорбентов они имеют относительно небольшой объем адсорбционных полостей, вследствие чего характеризуются сравнительно небольшими предельными величинами адсорбции. Гравиметрическая плотность синтетических цеолитов составляет 600–900 кг/м3.
Синтетические цеолиты могут быть получены с заданными размерами пор, что позволяет осуществлять специфическую адсорбцию молекул определенного размера и формы. Но даже с помощью этого приема не удается преодолеть склонность цеолитов предпочтительно адсорбировать полярные молекулы. Вследствие этого при наличии молекул воды они не поглощают органические молекулы, даже те, размеры которых соответствуют пористой структуре адсорбента.
Для увеличения селективности и поглотительной способности адсорбентов широко используются методы изменения их свойств путем обработки поверхности соответствующими реагентами. Этот процесс называют также импрегнированием.
Импрегнированные сорбенты можно разделить на три больших группы:
1) сорбенты, в которых пропитка представляет собой химический реагент;
2) сорбенты, в которых пропитка действует как катализатор непрерывного окисления или разложения загрязнителей;
3) сорбенты, в которых пропитка лишь периодически действует как катализатор.
Реакционно-способные пропитки в результате химической реакции превращают загрязнитель в безвредный адсорбируемый продукт. Углерод можно импрегнировать 10–20 мас.%брома, реагирующего с олефинами. Его применение особенно эффективно для удаления примесей этилена из воздушных потоков. Обычно этилен плохо адсорбируется вследствие низкой молекулярной массы. При контакте с поверхностью, содержащей бром, этилен превращается в 1,2-дибромэтан, который хорошо адсорбируется. По мере расходования свободного брома система теряет свою эффективность, и адсорбент должен быть заменен или регенерирован.
Иониты – высокомолекулярные соединения – пока еще не нашли широкого применения для очистки отходящих газов промышленности. Однако проведенные исследования показали возможность их использования для извлечения из газов кислых компонентов (оксидов серы и азота, галогенов и т. п.) на анионитах и щелочных – на катионитах.
Физические основы процесса адсорбции. Адсорбционная способность определяется силой взаимодействия между молекулами адсорбируемого вещества и частицами, находящимися в приповерхностных слоях адсорбента. Две крайние формы проявления силы адсорбционного взаимодействия получили название ван-дер-ваальсовых (дисперсионных) и обменных сил.
При физической адсорбции поглощаемые молекулы газов и паров удерживаются силами Ван-дер-Ваальса, при хемосорбции – химическими силами.
Благодаря постоянным колебаниям центров зарядов (электронных оболочек и ядер) атомов около среднего положения непрерывно возникают и исчезают дипольные, квадрупольные, высшие мультипольные моменты. Они создают в пространстве вокруг атомов пульсирующие электрические поля, характеристики которых могут быть вычислены в простейших случаях по уравнениям квантовой механики. Силы, возникающие при взаимодействии квантовых электрических полей частиц, участвующих в процессе адсорбции, называют вандерваальсовыми, или дисперсионными силами.
Дисперсионные силы действуют на границе раздела фаз и аналогичны силам взаимодействия между молекулами в объеме газа (силам межмолекулярного взаимодействия), обусловливающим отклонение характеристик реальных газов от идеальных. Согласно квантовомеханическим расчетам, силы Ван-дер-Ваальса резко убывают с увеличением расстояния между центрами зарядов взаимодействующих частиц (обратно пропорциональны 6-й степени расстояния) и на несколько порядков слабее обменных сил, создающих химическую связь. Однако в отличие от обменных сил дисперсионные могут действовать на относительно больших расстояниях (превышающих размеры молекул) и характеризуются ненасыщаемостью. Поле, создаваемое мгновенными дипольными моментами одной молекулы, может взаимодействовать с полями многих других молекул.
Считается, что при дисперсионных взаимодействиях обобществления электронов не происходит, и химическая связь не образуется. Одну из двух граничных моделей адсорбции, предполагающую, что при удержании молекул газа на поверхности адсорбента не происходит электронного обмена и образования химической связи, называют физической адсорбцией или зачастую просто адсорбцией.
В теоретических расчетах, выполняемых в рамках модели чисто физической адсорбции, учитывают кроме дисперсионного притяжения силу отталкивания зарядов. Ее принимают обратно пропорциональной 12-й степени расстояния между центрами зарядов. Если взаимодействующие частицы имеют постоянные дипольные моменты (например, молекулы воды или ионные поверхности) или свободные электроны (металлические поверхности), то между ними возникают и классические электростатические силы. Точный теоретический расчет их величины невозможен, хотя на практике они вносят существенный вклад в силу взаимодействия, а иногда и определяют характер процесса адсорбции.
Результаты теоретических расчетов характеристик физической сорбции имеют низкую сходимость с опытными данными и пригодны только для качественной оценки процессов.
Основными факторами, влияющими на протекание процесса адсорбции, являются: свойства адсорбента, температура, давление, свойства поглощаемых веществ и состав фазы, из которой они адсорбируются.
Процесс адсорбции газа твердым поглотителем является массообменным процессом и аналогично процессу абсорбции протекает в три стадии:
1) внешняя диффузия, т. е. диффузия молекул газа из потока к внешней поверхности адсорбента;
2) внутренняя диффузия, т. е. диффузия молекул газа от внешней поверхности адсорбента вглубь, в поры адсорбента;
3) собственно сорбция, т. е. фиксация молекул газа на поверхности или в объеме пор адсорбента.
Так как собственно сорбция протекает почти мгновенно, адсорбционный процесс определяется в основном скоростью внешней и внутренней диффузии.
Физическая адсорбция обусловлена взаимным притяжением молекул поглощаемого газа и адсорбента под действием неуравновешенных молекулярных сил в поверхностном слое; она не сопровождается изменением химического состава взаимодействующих веществ.
Процесс адсорбции протекает самопроизвольно тем интенсивнее, чем больше концентрация поглощаемого газа. Однако его ограничивает обратный процесс (десорбция), вызываемый стремлением к равномерному распределению вещества в связи с тепловым движением молекул. В результате этого по истечении некоторого времени устанавливается адсорбционное равновесие.
Независимо от характера сил, вызывающих адсорбцию, установившееся равновесное состояние описывается уравнением:
 , (101)
, (101)
где X – концентрация адсорбированного вещества в расчете на единицу массы адсорбента, кг/кг; Y – равновесная концентрация примеси в парогазовой смеси, кг/кг; A и n – коэффициенты, определяемые опытным путем, причем n ≥ 1.
Так как концентрация адсорбируемого вещества в смеси при постоянной температуре прямо пропорциональна его давлению, уравнение изотермы адсорбции можно записать в виде
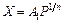 , (102)
, (102)
где A 1 – коэффициент пропорциональности.
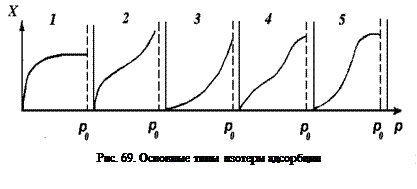 Зависимость количества адсорбированного вещества от давления, полученная при определенной температуре, графически изображается в виде кривой, которая называется изотермой адсорбции. Пять основных типов изотерм адсорбции, полученных экспериментально, приведены на рис. 69. Кривая 1 соответствует мономолекулярной адсорбции, когда молекулы адсорбата образуют на поверхности адсорбента слой толщиной в одну молекулу. Кривые 2 – 5 соответствуют различным вариантам полимолекулярной адсорбции.
Зависимость количества адсорбированного вещества от давления, полученная при определенной температуре, графически изображается в виде кривой, которая называется изотермой адсорбции. Пять основных типов изотерм адсорбции, полученных экспериментально, приведены на рис. 69. Кривая 1 соответствует мономолекулярной адсорбции, когда молекулы адсорбата образуют на поверхности адсорбента слой толщиной в одну молекулу. Кривые 2 – 5 соответствуют различным вариантам полимолекулярной адсорбции.
Равновесная концентрация X, кг/кг адсорбента,уменьшается с повышением температуры и увеличивается с возрастанием давления. Таким образом, адсорбция ускоряется при понижении температуры или при повышении давления. Аналогичные изотермы можно построить, выразив адсорбцию через поглощенный 1 г адсорбента объем газа при нормальных условиях – v.
Изотермы адсорбции могут быть выражены в аналитическом виде, причем существует ряд уравнений, описывающих различные типы процессов адсорбции. Наиболее известными являются уравнения Фрейндлиха, Ленгмюра, БЭТ(Брунауэра, Эммета, Тейлора). Последнее позволяет описать все пять основных типов изотерм.
При высоких температурах или малых парциальных давлениях примесей в газах изотермы адсорбции аппроксимируются законом Генри
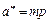 , (103)
, (103)
где m – коэффициент Генри, константа фазового равновесия; p – парциальное давление целевого компонента в очищаемом газе.
При практических расчетах часто используют эмпирическое уравнение Фрейндлиха, справедливое для мономолекулярной адсорбции,

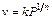 , (104)
, (104)
где v – адсорбированный объем; P – давление; k – коэффициент пропор циональности. Это уравнение совпадает с (89), отличие состоит лишь в форме выражения адсорбции и размерности коэффициентов.
Теоретически выведенное уравнение Ленгмюра, полученное для мономолекулярной адсорбции (справедливое и для хемосорбции),
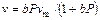 , (105)
, (105)
где v m – объем, адсорбируемый при мономолекулярном заполнении поверхности; b – коэффициент пропорциональности.
Уравнение БЭТ, пригодное для описания полимолекулярной адсорбции,
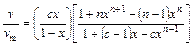 , (106)
, (106)
где x – функция, зависящая от давления; c – константа, связанная с величиной теплоты адсорбции; n – число адсорбированных слоев.
Материальный баланс процесса адсорбции. Различают стационарные и нестационарные адсорбционные процессы. Стационарные процессы характеризуются постоянством во времени концентрации адсорбата в каждой точке слоя поглотителя и являются непрерывными. В практике адсорбционной санитарной газоочистки наиболее распространены нестационарные периодические процессы.
Адсорбция в слое неподвижного адсорбента является периодическим процессом, при котором концентрация поглощаемого вещества в адсорбенте меняется во времени и в пространстве.
В адсорберах с неподвижным слоем газ непрерывно проходит через адсорбент, который в начальный момент времени не содержит адсорбата. Сначала адсорбент контактирует с поступающим газом, в котором содержание поглощаемого компонента велико. В результате прохождения через слой адсорбента почти все загрязняющее вещество удаляется из газа, и выходящий поток его не содержит. Рис. 70 иллюстрирует процесс при подаче газа сверху вниз; рис. 70, а соответствует случаю, когда выходящий поток практически не содержит адсорбата. Самая верхняя часть слоя насыщается, и основная адсорбция происходит в сравнительно узкой части слоя сорбента, где кон 


 центрация примеси быстро изменяется. Эта узкая адсорбционная зона смещается вниз по слою, образуя концентрационную волну (рис.70, б). Скорость смещения намного меньше, чем линейная скорость газа, проходящего через слой сорбента. С течением времени концентрация вещества в выходящем потоке возрастает (рис.70, в). Когда она достигает заранее заданного предельного значения, которое, например, может определяться требованиями законодательства по охране окружающей среды, считают, что произошел проскок. После этого концентрация вещества в очищенном газе быстро возрастает, так как адсорбционная зона выходит за пределы слоя сорбента (рис.70, г). В конечном итоге концентрация адсорбата на выходе становится такой же, как и в исходном газе. Зависимость концентрации от объема выходящего потока в этой области носит название кривой про
центрация примеси быстро изменяется. Эта узкая адсорбционная зона смещается вниз по слою, образуя концентрационную волну (рис.70, б). Скорость смещения намного меньше, чем линейная скорость газа, проходящего через слой сорбента. С течением времени концентрация вещества в выходящем потоке возрастает (рис.70, в). Когда она достигает заранее заданного предельного значения, которое, например, может определяться требованиями законодательства по охране окружающей среды, считают, что произошел проскок. После этого концентрация вещества в очищенном газе быстро возрастает, так как адсорбционная зона выходит за пределы слоя сорбента (рис.70, г). В конечном итоге концентрация адсорбата на выходе становится такой же, как и в исходном газе. Зависимость концентрации от объема выходящего потока в этой области носит название кривой про 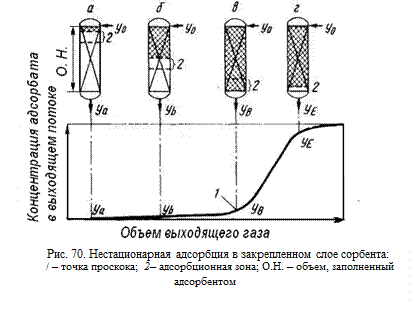 скока.
скока.
Адсорбенты характеризуются статической и динамической активностью. Количество вещества, поглощенное единицей массы (или объема) адсорбента за время от начала адсорбции до начала «проскока», определяет динамическую активность адсорбента. Количество вещества, поглощенное той же массой адсорбента за время от начала адсорбции до установления равновесия, характеризует статическую активность.
Активность адсорбента зависит от температуры газа и концентрации в нем поглощаемого компонента. Динамическая активность всегда меньше статической; поэтому при расчете адсорберов необходимый расход адсорбента определяется по его динамической активности.
Если пары вещества адиабатически адсорбируются из газовой смеси, то тепловыделение в процессе адсорбции описывается температурной кривой, которая проходит по слою сорбента аналогично кривой адсорбции. Повышение температуры выходящего потока может служить указанием на приближение проскока.
Время, через которое происходит проскок, и форма кривой проскока оказывают значительное влияние на режим работы адсорберов с неподвижным слоем. Форма кривой определяется фактической скоростью и механизмом адсорбционных процессов, типом адсорбции, скоростью подачи газа, концентрацией поглощаемого вещества в газе и высотой слоя сорбента. В некоторых случаях точка проскока выражена очень резко, а иногда ее весьма трудно обнаружить.
Как правило, время до наступления проскока уменьшается с уменьшением высоты слоя и увеличением размера частиц адсорбента, ростом скорости подачи газа и концентрации примесив нем. При проектировании адсорберов требуется определять время до наступления проскока, для чего необходимо построение кривой проскока.
Стационарный процесс адсорбции происходит в аппаратах с движущимся адсорбентом. Если адсорбент движется через аппарат, адсорбция происходит непрерывно и материальный баланс процесса выражается уравнением общим для всех процессов массопередачи. При рассмотрении методов проектирования стационарных адсорберов с движущимся слоем предполагается, что процесс протекает в изотермических условиях и адсорбируется только один компонент. В этом случае процесс аналогичен абсорбции газа, отличие состоит лишь в замене жидкого поглотителя твердым.
Примем, что газ (в количестве G за единицу времени), проходя за время dt слой адсорбента высотой dH, изменяет свою концентрацию на величину dY и, следовательно, отдает количество вещества GdYdt. За это же время концентрация поглощаемого вещества в элементе слоя увеличивается на dX и количество вещества, поглощенного слоем высотой dH, составляет SdHρdX, где S – площадь поперечного сечения адсорбента; ρ – насыпная масса адсорбента. Тогда уравнение материального баланса будет иметь вид:
– G dY dt=S dH ρ dX. (107)
Расчет адсорбционных процессов предполагает наличие кинетических уравнений, выражающих величину адсорбции как функцию времени осуществления реального процесса.
Для выявления характера распределения концентраций поглощаемого вещества в газовой фазе и в слое адсорбента в данный момент времени, необходимо составить и решить, при соответствующих начальных и граничных условиях, систему уравнений материального баланса, изотермы и кинетики адсорбции, гидродинамики процесса. Решение такой системы уравнений представляет очень сложную задачу и возможно лишь при использовании ряда допущений и приближений, рассмотрения частных, наиболее простых случаев динамики адсорбции.
Время появления за слоем адсорбента очищенного газа, состав которого соответствует заданной допустимой концентрации целевого компонента, характеризует время защитного действия слоя адсорбента τпр для конкретных условий реализации адсорбционного процесса.
Вслед за этим происходит окончательное насыщение слоя адсорбента целевым компонентом, и концентрация его в газе на выходе растет до тех пор, пока не сравняется с начальной.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1263; Нарушение авторских прав?; Мы поможем в написании вашей работы!