
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
M г 448 л
|
|
|
|
Составим пропорцию:
по стехиометрии реакции при сжигании топлива C5H12(ж):
1 моль (М =72 г/моль) C5H12(ж) - выделяется 5Vm =112 л(н.у) CO2(г) и ∆H0cг C5H12(ж) = 3590,28 кДж/моль
n моль (m C5H12(ж), г) C5H12(ж) - выделяется V CO2 = 448 л(н.у) CO2(г) и Q кДж тепла
Сожгли m C5H12(ж) = VCO2∙ МC5H12/5Vm = 448 ∙ 72/112 = 288 г C5H12(ж)
или n C5H12(ж) = VCO2 /5Vm = 448 /112 = 4 моль C5H12(ж).
Получили Q = -∆H0cгC5H12(ж) ∙ n C5H12(ж) = -(-3590,28)кДж/моль ∙ 4 моль = 14361 кДж = 14,361 мДж тепла.
Задача 9
Вычислить количество тепла, выделяющееся при сгорании 100 м3 этилена C2H4(Г) (условия нормальные). Написать уравнение процесса горения
Решение:
Дано: V C2H4(г) = 100 м3 (н.у.)
Определить Q
Уравнение реакции:
C2H4(г) + 3 O2 (г) = 2 CO2(г) + 2 H2O(ж) ∆H0cг C2H4(Г) = -1312,00 кДж/моль
.
По следствию из закона Гесса:
∆H0cг C2H4(Г)=2∆fH0CO2 (Г) +2∆fH0H2O(Ж) - ∆fH0C2H4(Г)- 3∆fH0O2 (г) =2(-396,3)+2(-285,84) –52,28 – 0 = -1312,00 кДж
Vm =22,4 л/моль (н.у) – мольный объем любого газа при нормальных условиях.
По уравнению реакции при сжигании топлива C2H4(Г
Vm =22,4 л/моль (н.у) C2H4(Г) (1 моль) - выделяется (- ∆H0cг C2H4(Г))= 1312,00 кДж/моль тепла
V = 100 м3 (н.у.) C2H4(Г) - выделяется Q кДж тепла____________________
Q = -∆H0cг (C2H4(Г) ∙V C2H4(г)∙1000 / Vm= - (-1312,00)кДж/моль∙(100∙1000)л /22,4 л/моль = 5857∙103 кДж = 5857 МДж тепла
Зависимость Δ rН 0 от температуры:
В интегральном виде для области температур (298 ÷ Т) К, уравнение Кирхгофа:
∆ rH0T = ∆ rH 0298 + 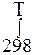 ∆ rС0pdT
∆ rС0pdT
Сp о – теплоемкость вещества, функция состояния системы
∆ rСp о - изменение стандартной теплоемкости системы в ходе реакции
∆ rСp о =∑ν i Срi 0 прод -∑ν j Срj 0исх веществ
В отсутствие фазовых переходов веществ:
1-приближение: Ср ¹ ¦(Т) (Ср,i =соnst), тогда ∆rС0р= соnst ∆rН0Т = ∆rН0298 + ∆rС0р(Т - 298)
2 – приближение: при Т ~ 298 К ∆ rС 0 р,i = 0 ∆ rH0T = ∆ rH 0298
3 – есть фазовый переход в области температур (298 ÷ Т) К
∆ rН 0 Т = ∆ rН 0298 + ∆ rС 0 р(1) (Т фп - 298) +∆ rН 0фп + ∆ rС 0 р(2) (Т - Т фп)
2–ой закон термодинамики: в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т.е. ∆ S > 0.
S - энтропия мера неупорядоченности состояния системы. Чем больше порядок, тем меньше S. S – функция состояния системы
Неупорядоченность системы определяется ее макросостоянием, определяемым либо параметрами (P, T…), либо через громадное число микросостояний составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения частиц в различных направлениях. Число микросостояний системы, с помощью которых может быть охарактеризовано ее макросостояние, называют термодинамической вероятностью W: S = k lnW, Дж/(моль·К)
k – постоянная Больцмана k = R/Nа =1.38×10-23 Дж/К
3–ой закон термодинамики (М. Планк): при абсолютном нуле энтропия идеального кристалла равна нулю (полная упорядоченность) W=1, S = k ln1 = 0
S вещества растет с увеличением температуры и скачкообразно возрастает в точках фазовых переходов
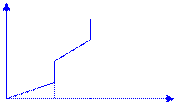 S, Дж/(моль·К)
S, Дж/(моль·К)
газы – носители S
Тпл Ткип Т, К
Для любой Т можно определить абсолютное значение S чистого вещества.
Cтандартная энтропия S0, Дж/(моль×К) - энтропия вещества, находящегося в стандартном состоянии. S 0298 - справочные данные.
Задача 10
Дайте качественную оценку изменения энтропии реакций: а) Ст + СО2,г ® 2СОг DrS0= 87 Дж/К; б) 3Н2,г+ N2,г ® 2NH3,г DrS0= -90 Дж/К; в) Ст + О2,г ® СО2г; DrS0=2,9 Дж/К.
Решение
а) Ст + СО2,г ® 2СОг DrS0= 87 Дж/К > 0 – неупорядоченность системы увеличивается за счет увеличения объема системы (изменение числа молей газов ∆nгаз = 2-1=1>0);
б) 3Н2,г+ N2,г ® 2NH3,г DrS0= -90 Дж/К< 0 - неупорядоченность системы уменьшается за счет уменьшения объема системы (∆nгаз = 2-3-1=-2<0);;
в) Ст + О2,г ® СО2г; DrS0=2,9 Дж/К@0 объем системы практически не изменяется (∆nгаз = 1-1=0), но DrS0>0 за счет усложнения молекул: из двух простых веществ – Ст и О2 газ образуется газообразное сложное вещество СО2 газ.
Изменение энтропии системы при теплообмене с окружающей средой Δ S = Q/T; при фазовом переходе Δ Sфп= ∆ Hфп /Tфп. Изменение энтропии химической реакции: Δ rS = ∑ν i Si продуктов - ∑ν j Sj исх веществ
Для стандартных состояний веществ и Т=298 К: Δ rS 0298 = ∑ν iS 0298, i продуктов - ∑ν jS 0298, j исх веществ
Δ rS 0298 – стандартная энтропия реакции при 298К
Зависимость Δ rS от температуры:
в области (298 ÷Т)нет фазовых переходов: ∆rS0T = ∆rS0298 + 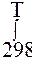
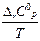 dT
dT
1 приближение: Ср ¹ ¦(Т) (Ср,i = соnst), тогда ∆rС0р= соnst и ∆ rS0T = ∆ rS 0298 + ∆ rС 0 р ln 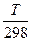
2 приближение: при Т ~ 298 К ∆ rС 0 р,i = 0 и ∆ rS0T = ∆ rS 0298
3 - в области (298 ÷ Т) К есть фазовый переход . Для приближенных расчетов:
∆ rS 0 Т = ∆ rS 0298 + ∆ rС 0 р(1) (ln Т фп - ln298) +∆ rS 0фп + ∆ rС 0 р(2) (lnТ - ln Т фп)
Зависимость S реакции от Р особенно заметна в случае газовых реакций: ∆ Si =Sрi – S0i = - R ln(p/p0)изменение энтропии 1 моля газа при увеличении давления от 1 атм до р: ∆ Si = - R ln 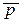 i
i
Задача 11
Определите ∆rH0298, ∆rH01000, ∆rS0298 и ∆rS01000 реакции С(к) + СО2(г) = 2СО(г), считая постоянными теплоемкости реагентов в данном температурном интервале.
Решение. ∆rН0Т = ∆rН0298 + ∆rС0р(Т - 298) ∆ rS0T = ∆ rS 0298 + ∆ rС 0 р ln 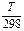
Табличные данные:
| Вещество | ΔfН0298,кДж/моль | S0298,Дж/(моль.K) | С0р298,Дж/моль.К |
| С(графит) | 0,0 | 5,74 | 8,54 |
| СО2 (г) | -393,5 | 213,68 | 37,41 |
| СО (г) | -110,5 | 197,54 | 29,14 |
По следствию из закона Гесса ΔrН0298 = ∑ν iΔfНi0 продуктов -∑νjΔfНj 0исх веществ = ΔfН0298 СОг -ΔfН0298 Ск -ΔfН0298 СО2г = 2(-110,5) – 0 – (-393,5) = 172,5 кДж > 0 - реакция эндотермическая
Т.к. Ср – функция состояния, то ∆rС0р = ∑ν iСр i0 продуктов - ∑νjСр j 0исх веществ = 2С0р298СОг–С0р298Ск–С0р298СО2г= 2.(29,14)–8,54–37,41 =12,33 Дж/К.
∆rН01000 =172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж.
│(∆rН0298 - ΔrН01000)│100% /│ΔrН0298│ = │(172,5 - 181,16)│100% /172,5 = 5%.
Так как S – функции состояния, то Δ rS0298 =∑νiS0298,i прод. - ∑νjS0298,j исх веществ =2S0298,СОг - S0298,Ск - S0298,СО2г = 2(197,54)–5,74–213,68=175,66 Дж/K>0 – неупорядоченность системы повышается т.к. реакция протекает с увеличением числа молей газов (Δ nгаз = 2-1=1 >0).
∆rS01000 =∆rS0298 + ∆rС0рln 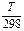 =175,66+12,33ln(1000/298)=175,66+14,93=190,59 Дж/К. При DT = 702К
=175,66+12,33ln(1000/298)=175,66+14,93=190,59 Дж/К. При DT = 702К
│(∆rS0298 - ΔrS01000) │100% /│ΔrS0298│ = │ (175,66 - 190,59 │100% /175,66 @ 8,5%.
При изменении температуры на 702 К увеличение теплового эффекта составляет 5%, а энтропии – 8,5%.
| Направление химических процессов. Энергия Гиббса. Энергия Гельмгольца Направление процесса определяется соотношением энтальпийного ∆rН (стремление системы к упорядоченности) и энтропийного Т∙∆rS (стремление системы к хаотичности) факторов реакции. Функцией состояния системы, учитывающей совместное влияние ∆rН и Т∙∆rS на самопроизвольное протекание реакции, является свободная энергия: -при P, Т = const это энергия Гиббса или изобарно-изотермический потенциал ∆rGТ=∆rНТ - Т∙∆rSТ - при V, Т = const это энергия Гельмгольца или изохорно-изотермический потенциал ∆rFТ=∆rUТ - Т∙∆rSТ Критерий термодинамической возможности самопроизвольного протекания реакции в прямом направлении: · в изобарно-изотермических условиях: ∆rGТ < 0 · в изохорно-изотермических условиях: ∆rFТ <0 Соотношение между ∆rGТ и ∆rFТ: ∆rGТ - ∆rFТ = ∆n·RT A пол = - D G «свободная энергия», та часть теплового эффекта, которую можно превратить в работу. Т Δ S «связанная энергия», та часть теплового эффекта, которая рассеивается в окружающую среду D rG < 0Самопроизвольный процесс - реакция в прямом направлении D rG > 0 Реакция в обратном направлении D rG = 0 Реакцияв равновесномсостоянии | |||||||||
| знак | Принципиальная возможность и условия протекания прямой реакции | ||||||||
| ∆ rН | ∆ rS | Dr G | |||||||
| - | + | - | Возможна при любой температуре | ||||||
| + | - | + | Невозможна. Возможна в обратном направлении | ||||||
| - | - | - | Возможна при низких температурах 298 < Т< Тр | ||||||
| + | + | - | Возможна при высоких температурах Тр< Т< Тсущ | ||||||
Dr G рассчитывают двумя способами:
· 1 способ При Т=298К Δ rG0298 = ∑ν iΔfG0298,i продуктов - ∑ν jΔfG0298,j исх веществ
Энергия Гиббса образования вещества ∆ fG – энергия Гиббса реакции образования 1 моль сложного вещества из простых веществ, устойчивых в данных условиях
∆ fG0- стандартная энергия Гиббса образования вещества (вещества находятся в стандартном состоянии) ∆ fG 0298, -табулирована [кДж/моль] ∆ fG 0298 (простых веществ)= 0
· 2 способ Δ rGT = ∆ rHT - T ∆ rST (зависимости ∆ rH и ∆ rS от Т – см. выше )
Δ rG0298 = ∆ rH0298 - T ∆ rS0298
Когда ∆ rС 0 р,i = 0: Δ rG0Т = ∆ rH0298 - T ∆ rS0298
Задача 12
Рассчитать ∆rH0298 , ∆rS0298 , ∆rG0298 (двумя способами) реакции С(к) + СО2(г) = 2СО(г) и сделать вывод о возможности самопроизвольного протекания реакции при стандартных состояниях веществ и 298 К.
Решение: Табличные данные:
| Вещество | Δ fН 0298, кДж/моль | S0298, кДж/(моль.K) | ∆f G0298, кДж/моль |
| С(графит) | 0,0 | 5,74 | 0,0 |
| СО2 (г) | -393,5 | 213,68 | -394,4 |
| СО (г) | -110,5 | 197,54 | -137,14 |
Следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов ν
Так, для веществ в стандартных состояниях при Т=298 К (табличная Т)
ΔrН0298 =∑ν i Δ fНi 0 298 продуктов -∑ν j Δ fНj 0 298 исх веществ= 2ΔfН0298 СО (г)- ΔfН0298 С (к) - ΔfН0298 СО2 (г) =2(-110,5)–0 –(-393,5) = 172,5 кДж. ΔrН0298 >0 - реакция эндотермическая
S и G – функции состояния и для них:
Δ rS 0298 =∑ν iS 0298, i продуктов-∑ν jS 0298, j исх веществ =2S0298СО (г) -S0298 С (к)- S0298 СО2 (г) = 2(197,54)–5,74–213,68=175,66 Дж/K Δ rS 0298 >0 - реакция протекает с увеличением числа молей газообразных веществ ∆νгаз = 2 – 1 = 1 >0
Δ rG0298 = ∑ν i Δ fG0298,i продуктов - ∑ν j Δ fG0298,j исх веществ = 2Δf G0298 СО (г) - Δf G0298 С (к) - Δf G0298 СО2 (г) =2(-137,14) – 0 – (-394,4) = 120.09 кДж
2 способ: при Т=298 К ∆ rG0298 = ∆ rH0298 - T ∆ rS0298 = 172,5 – 298.175,66.10-3 = 120,15 кДж
Значения ∆ rG0298, рассчитанные двумя способами практически совпадают.
Критерий термодинамической возможности самопроизвольного протекания реакции в прямом направлении в изобарно-изотермических условиях – уменьшение энергии Гиббса системы: ∆rGТ < 0
Т.к. ∆ rG0298 > 0 – самопроизвольное протекание реакции при стандартных состояниях всех участников и Т=298 К в прямом направлении невозможно, реакция будет протекать в обратном направлении.
Задача 13
Определить температурную область самопроизвольного протекания реакции С (к) + СО2 (г) = 2СО (г) при стандартных состояниях компонентов (ΔrН0298 = 172,5 кДж, ∆r S0298 = . 175,66 Дж/К)
Решение
| Вещество | Интервал температур, .К |
| С(графит) | (298 – 2300) К |
| СО2 (г) | (298 – 2500) К |
| СО (г) | (298 – 2500) К |
Тсущ. = 2300 К (для наименее устойчивого вещества - графита)
∆rGТ=∆rНТ - Т∙∆rSТ - энергия Гиббса или изобарно-изотермический потенциал, это функция состояния системы, учитывающая совместное влияние энтальпийного (∆rН) и энтропийного (Т∙∆rS) на самопроизвольное протекание реакции при P, Т = const (свободная энергия).
Реакция протекает самопроизвольно при стандартных состояниях компонентов, если ∆ rG0Т = ∆ rH0298 - T ∆ rS0298 < 0. С учетом приближения 2: ∆rH0Т = ∆ rH0298 и ∆rS0Т = ∆ rS0298 ( энтальпия и энтропия реакции не зависят от температуры), график зависимости ∆ rG0Т (Т) линейный.
При температуре равновесия Тр = ∆ rH0298 /∆ rS0298 = 172,5/175,66.10-3 = 928 K – равновероятно протекание как прямой, так и обратной реакции т.к. при этой температуре ∆ rG0Т = 0.
Энтальпийный фактор (стремление системы к упорядоченности) ΔrН0298 = 172,5 кДж >0 не способствует протеканию реакции при низких температурах, а энтропийный фактор (стремление системы к хаотичности) Т∙∆r S0298 = Т . 175,66 Дж >0 определяет отрицательный знак энергии Гиббса при высоких температурах. Сл. самопроизвольное протекание процесса при стандартных состояниях возможно при Т >Тр.
Область температур, в которой возможно самопроизвольное протекание реакции при стандартных состояниях веществ ( ∆ rG0Т <0):
∆ rG0Т, кДж
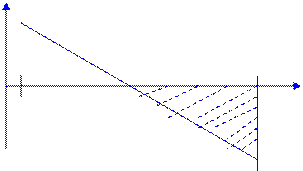 Тр= 982 К < Т < 2300К = Тсущ..
Тр= 982 К < Т < 2300К = Тсущ..
∆ rG0298 = 120,09
∆ rG0Т = ∆ rH0298 - T ∆ rS0298
ТрТсущ
298 982 2300 Т, К
∆ rG0Т <0
Зависимость Δ rGT от давления - изотерма Вант Гоффа:
Для реакции: a Aг + b Bг + d Dк = e Eг + f Fг  Δ rGТ =∆ rG0Т + RT ln
Δ rGТ =∆ rG0Т + RT ln 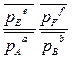
где  – относительные парциальные давления газообразных веществ.
– относительные парциальные давления газообразных веществ.
Для реакции: a A(р)+ b B(р) +d D(к) = e E(р) +f F(р ) протекающей в идеальном растворе (∆V = 0) ∆r GºT= ∆r FºT= - RTln (ceE равн cfF равн / caA равн cbB равн)
Задача 14
При каком соотношении парциальных давлений газообразных компонентов реакции С (к) +СО2 (г) =2СО (г) возможно ее протекание в прямом направлении при 298К (∆ rG0298 = 120,15 кДж)?
Решение
Возможность самопроизвольного протекания реакции определяется ∆ rG298< 0
По уравнению изотермы Вант-Гоффа: Δ rG298 = ∆rG0298 + RT ln 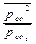 < 0.
< 0.
Пусть 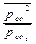 = х, тогда 120,15+8,31.10-3.298 lnх<0, отсюда lnх<-48,5 Þ х=
= х, тогда 120,15+8,31.10-3.298 lnх<0, отсюда lnх<-48,5 Þ х= 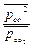 <10-21 или
<10-21 или 
Задача 15
Определите, изменится ли направление протекания процесса при уменьшении парциального давления исходного газообразного вещества до 10 Па для реакции С(к)+СО2(г)=2СО(г) при Т = 1000 К (ΔrН0298 = 172,5 кДж, ∆r S0298 = . 175,66 Дж/К)
Решение
Зависимость ΔrGT от давления выражается изотермой Вант Гоффа (С(к)- вещество в кристаллическом состоянии не входит в 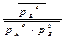 ):
):
ΔrGТ = ∆rG0Т + RTln 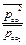 при Т=1000 К ΔrG1000 = ∆rG01000 + RTln
при Т=1000 К ΔrG1000 = ∆rG01000 + RTln 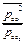
Энергия Гиббса реакции при стандартных состояниях веществ, т. е. относительных парциальных давлениях СО2 и СО равных 1: Δ rG0Т = ∆ rH0298 - T ∆ rS0298 (считая ∆ rС 0 р = 0, т.е. ∆rH0Т = ∆ rH0298 и ∆rS0Т = ∆ rS0298 - энтальпия и энтропия реакции не зависят от температуры)
при Т=1000К Δ rG01000 = 172,5- 1000∙175,66.10-3 = -3,16 кДж ˂ 0 – возможно самопроизвольное протекание реакции при стандартных состояниях и Т=1000К
Для заданных начальных состояниях веществ, отличных от стандартных 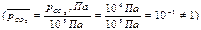 ΔrG1000 = -3,16+8,31. 10 -3. 1000 ln(1/10-1) = -3,16+19,11=15,95 кДж ˃ 0 - направление протекания процесса при уменьшении парциального давления исходного газообразного вещества до 10 Па изменилось и самопроизвольное протекание процесса в прямом направлении при заданных начальных условиях и Т=1000 К невозможно.
ΔrG1000 = -3,16+8,31. 10 -3. 1000 ln(1/10-1) = -3,16+19,11=15,95 кДж ˃ 0 - направление протекания процесса при уменьшении парциального давления исходного газообразного вещества до 10 Па изменилось и самопроизвольное протекание процесса в прямом направлении при заданных начальных условиях и Т=1000 К невозможно.
∆ rG01000 ˂ 0 ˂ Δ rG1000
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 366; Нарушение авторских прав?; Мы поможем в написании вашей работы!