
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Структура тугоплавких простых и сложных оксидов, карбидов, боридов и силицидов
|
|
|
|
К простым относятся оксиды, содержащий какой – либо один вид атома метала, к сложным – оксиды, в состав которых входят два и более различных видов атомов металлов. К последним, в частности, принадлежат многочисленные технически важные двойные оксиды типа шпинелей.
Весьма распространенным среди простых оксидов металлов с общей формулой Ме2+О является структуный тип каменной соли (NaCl).Кубическую решетку со структурой NaCl имеют MgO,CaO, SrO, BaO, CdO, Vo, MnO, FeO, CoO, NiO.
Особенностью строения кристаллической решеток оксидов являются то, что их основу составляет плотная кубическая или гексагональная упаковка ионов кислорода. В подобных оксидов с небольшим ионным радиусом катиона метала этот катион занимает все октаэдрические пустоты в плотной упаковке из анионов кислорода.
В некоторых простых оксидах с общей формулой Ме2+О, кристаллизующихся в в структурном типе вюрц ита, например Pb, BeO,ZnO, катионы метала располагаются периодически в половине тетраэдрических пустот плотной гексагональной упаковки атомов кислорода.
В простых оксидах с общей формулой Ме23+О3 часто встречается структурный тип корунда, которому принадлежит кроме α-Al2O3, например, структуры гематита α – Fe2O3, Cr2O3, V2O3 и тд.
Многие оксиды с простой формулой Ме4+О2 кристаллизуются в структурном типе флюорита CaF2,например: NiO2, CaO, VO2,ZrO2 (гексагональная структура флюорита) или структурном типе рутила TiO2 ,например: GeO2, TiO2, WO2 и др.
Большая группа сложных двойных оксидов кристаллизуется в структурном типе шпинели. К шпинелям относятся кристаллизирующиеся в кубической системе двойные оксиды с общей формулой Ме2+О * Ме23+О3 ,
где: Ме2+ - Mg, Fe, Mn, Zn, Be, Ni, Co, Cr, Cd, Pb,
Ме3+- - различают алюмошпинели (например благородный шпинель MgO *Al2O3, герценит FeO* Cr2O3), хромошпинели (например ферохромит FeO* Cr2O3) и т.д
|
|
|
Сходство структур и параметров решетки меньших шпинелей обуславливает одну из особенностей – легкость образования между ними твердых растворов замещения.
Карбид кремния (карборунд) – углеродистый кремний впервые был получен в 1824г. шведским химиком Берцелиусом. Известны две полиморфные кристаллические модификации карбида кремния – кубическая 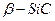 (решетка типа алмаза а=0,4359нм.) и гексагональная
(решетка типа алмаза а=0,4359нм.) и гексагональная  (слоистая структура с параметрами а=в=0,3078 нм. и с=0,2518 n нм, где n- число слоев в гексагональной ячейке). В интервале температур 2100-2400о С кубическая модификация монотропно переходит в гексагональную.
(слоистая структура с параметрами а=в=0,3078 нм. и с=0,2518 n нм, где n- число слоев в гексагональной ячейке). В интервале температур 2100-2400о С кубическая модификация монотропно переходит в гексагональную.
Карбид встречается в природе виде мелких кристаллов, иногда в ассоциации с мельчайшими кристаллами алмаза. Кристаллы карборунда обнаружены в метеоритных кратерах, алмазных трубках, вулканических извержениях.
В промышленных условиях карбид кремния получают в электропечах при 2000-2200о С и нагревом смеси кварца с коксом или термоантрацитом по реакции, требующей больших затрат теплоты:
SiO2 + 3C 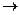 SiC + 2CO –Q
SiC + 2CO –Q
Или (при меньших затратах теплоты) прямым методом из кремния и углерода.
Химически чистый карбид кремния бесцветен, а технический окрашен в зеленоватый цвет или сине – черный цвет примесями Fe, Al, Mg, Zn,Ti, Cr. Карборунд химически стоек. Он не реагирует с кислотами, за исключением смеси концентрированных HF и HNO3 .
Расплавленные металлы Mg,Mn, Al, Fe,Co, Ni, Cr,Pt, взаимодействуют с карбидом кремния, тогда как Zn, Pb,Cu с ним не реагируют.
Карборундовые материалы отличаются высокой теплопроводностью, термостойкостью, стойкостью к коррозионному воздействию кислых шлаков, абразивной стойкостью и жаростойкостью, относительно высокой электрической проводимостью.
Карборунд используется в качестве абразивного материала (порошки, круги, шлифовальная и наждачная бумага) при обработки металлов и сплавов, камня, а так же для изготовления высокотемпературных нагревателей. Наиболее важные области применения карбида кремния связаны с его особыми электрическими, в том числе полупроводниковыми свойствами.
|
|
|
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 768; Нарушение авторских прав?; Мы поможем в написании вашей работы!