
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
З. Понятие о синтезе химико-технологической системы
|
|
|
|
3.1. Задачи синтеза химико-технологической системы.
Задачи синтеза ХТС заключаются в выборе: а) основных технологических операций; б) структуры технологических связей; в) параметров технологического режима отдельных элементов и параметров системы, которые должны обеспечить оптимальное функционирование всей системы, создание высокоэффективных производств. При оценке вариантов структуры технологических связей в ХТС, одновременно решаются вопросы, относящиеся к выбору технологических и конструкционных параметров элементов ХТС, которые необходимы для согласованной между собой работы элементов. Таким образом, выбранный способ комбинации технологических связей должен обеспечить выполнение принципов, положенных в основу построения ХТС. Конечно, можно попытаться из многообразия типов узлов подобрать такие связи между ними, которые образуют ХТС с необходимыми показателями. Но простой подбор не реален, даже с использованием совершенных ЭВМ. Знание теоретических основ химической технологии и человеческий опыт позволяет найти ряд решений наилучших для достижения каких-то показателей ХТС, выполнявших определенные требования к ХТС. Среди них выделим глубину и полноту переработки сырья, минимизацию энергетических и тепловых затрат, минимизацию отходов, оптимальное использование оборудования. Поскольку эти требования должны всегда выполняться, назовем их концепциями создания ХТС.
Приемы, с помощью которых эти требования могут быть осуществлены, представляют собой ряд решений, обоснованных теорией химико-технологических процессов, инженерной проработкой и подтвержденные практикой. Набор таких решений называют еще эвристиками.
Конечно, таких решений может быть много. Ниже рассмотрим наиболее распространенные из них, показав примеры их реализации.
3.3. Texнологические концепции создания ХТС.
3.2.1. Глубина переработки сырья в продукты - требование максимально возможного выхода полезного продукта. Некоторые решения этой концепции - следующие:
I) Выбор процесса
Например, хлорвинил можно получить в двухстадийном процессе - хлорированием этилена с последующим дегидрохлорированием:

Общий выход хлорвинила из этилена в этом случае не выше 90 %. Е сли выбрать другой процесс - окислительное гидрохлорирование этилена

то в одну стадию можно увеличить выход продукта до 95 %.
2) Избыток одного из реагентов, как правило, более дешевого и доступного. Увеличение выхода достигается, например, вследствие сдвига равновесия за счет избытка одного из реагентов. Например, в конверсии метана

По стехиометрии соотношение Н2О: СН4 = I: I и равновесная степень превращения СН4 составляет Хр = 48 % (температура 900°С, давления 30∙105Па). Если взять избыток легкодоступного пара, так чтобы соотношение Н2О: СН4 = 4, то будет достигнута при тех же условиях Хр = 94%.
3) Противоточный контакт фаз - известное решение, обеспечивающее максимальную движущую силу процесса. Примеры – противоточное движение двух потоков в теплообменнике, газа и жидкости в абсорбере и т. д.
4) Фракционный рецикл, когда после разделения продукта и непрореагировавшего сырья, последнее возвращается на последующую переработку.
3.2.2. Полнота переработки сырья и вспомогательных материалов - требование максимальной степени превращения сырья в полезные продукты. Если полезный продукт единственный, то эта концепция и предыдущая совпадают (выход продукта и степень превращения совпадают). Некоторые решения этой концепции.
I) Выбор процесса - наиболее принципиальный и эффективный путь решения. Выше был приведен пример двухстадийной схемы получения хлорвинила. Один из недостатков - наличие побочного продукта НСl и, как следствие, низкое использование хлора в этом процессе. Этилен получают пиролизом нафты. Если изменить условия пиролиза, то можно получить примерно равные количества этилена и ацетилена в этом процессе. Тогда выделяющийся при хлорировании этилена HCI можно направить на гидрохлорирование ацетилена и также получить хлорвинил (рис.13)
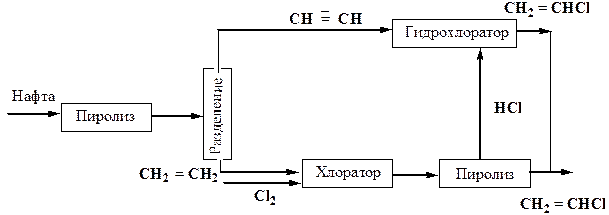
Рис. 13. Получение хлорвинила
В этом процессе обеспечивается полнота переработки С12, а также нафты.
2) Регенерация с рециклом - вспомогательный материал после использования в процессе регенерируют и возвращают в процесс. Например, в схеме очистки азото-водородной смеси от CO2 (производство аммиака) используют поглотитель - моноэтаноламины (МЭА). После абсорбции СО2 раствором МЭА, последний направляют в десорбер, где при повышенной температуре десорбируют из него СО2 и регенерированный МЭА раствор возвращают в абсорбер.
3) Утилизация отходов позволяет получать полезные продукты отходящего потока. При этом выход основного продукта может не изменяться, однако общая степень превращения сырья в полезные продукты будет увеличена.
4) Совмещение производств позволяет превратить один из побочных продуктов в другом химическом производстве, созданном вместе с основным производством. Например, выделенный при МЭА-очистке СО2можно направить на синтез карбамида, используя полученный аммиак.
3.2.3 Минимизация энергетических и тепловых расходов должна решать задачу экономии энергетических ресурсов. Некоторые решения этой концепции.
1) Регенерация тепла. В ряде случаев для проведения процесса (например, в реакторе) необходимо нагреть поток. Его можно нагреть за счет тепла, выходящего из реактора потока. Такая схема была приведена на примере перекрестной технологической связи. Наиболее эффективно такое решение будет, если реакция экзотермическая.
2) Регенерация энергии. Используется для процессов под давлением. В этом случае сжатые газы направляются на турбину, которая приводит в действие нагнетатель (компрессор), сжимающий исходный поток.
3) Утилизация тепла - тепло (или энергия) потока используются для получения пара в котле-утилизаторе, который поступает в заводскую теплосеть или для каких-либо других целей.
4) Химико-энергетическая система (энерготехнологическая) - ХТС включающая энергетический узел и позволяющая наиболее эффективно использовать энергетический потенциал топливных ресурсов и обеспечивающая автономную по энергии работу химического производства. Примером могут служить производства аммиака и азотной кислоты. Схемы, принципиально демонстрирующие организацию химико-энергетических систем, показаны на рис. 14 и 15.
В производстве аммиака имеется стадия паровой конверсии метана (рис.14), для чего используется пpиpoдный газ (технологический – Гт). Это эндотермический процесс. Его проводят в трубчатом реакторе (2). В трубках находится катализатор, на котором протекает конверсия природного газа. Создание необходимой температуры процесса - около 800°С - достигается обогревом трубок за счет сгорания природного газа (Гн) в межтрубном пространстве.

Рис. 14. Принципиальная схема энергетического
узла в ХТС производства аммиака: _._
I - паровой котел; 2 - трубчатый реактор; 3 - турбокомпрессор высокого давления;.4,6 - паровая турбина; 5 – компрессор природного газа.
Горячие газы после трубчатого конвертора используются для получения пара высоких параметров. Вода для получения пара сначала нагревается в теплообменниках всей технологической схемы производства аммиака, где можно регенерировать тепло процесса, и направляется в паровой котел (I), обогреваемый газами после конвектора.
Получаемый пар используется для привода турбокомпрессора высокого давления(З) и компрессора природного газа (5). Однако собранного тепла не хватает для обеспечения необходимой мощности турбокомпрессоров. Поэтому в топке (I) сжигают дополнительное количество природного газа, покрывая этот дефицит энергии. Таким образом, в технологической схеме производства аммиака появляется энергетический узел выработки пара высоких параметров, обеспечивающий энергией всё производство и максимально использующий тепло всех потоков этого же производства. При соответствующем выборе параметров энергетического узла вся химико-технологическая система становится автономной по энергии.
В современном производстве азотную кислоту получают под давлением. После абсорбционной колонны отходящие газы (в основном, азот с небольшим количеством кислорода и остатками оксидов азота) направляются на газовую турбину (2) для использования энергии отходящего газа (рис.15). Но его энергетический потенциал не достаточен для того, чтобы компенсировать затраты энергии на сжатие воздуха, поступающего в процесс, потому что часть энергии сжатого воздуха была затрачена на получение азотной кислоты, да и объём отходящего потока меньше, чем воздуха.
Компенсируют этот дебаланс увеличением температуры отходящих, газов путем сжигания природного газа (СН4) в горелке (4). Энергия сжатого газа увеличивается за счёт увеличения его температуры и её хватает для того, чтобы газовая турбина (2) могла обеспечить привод необходимой мощности для компрессора (1).
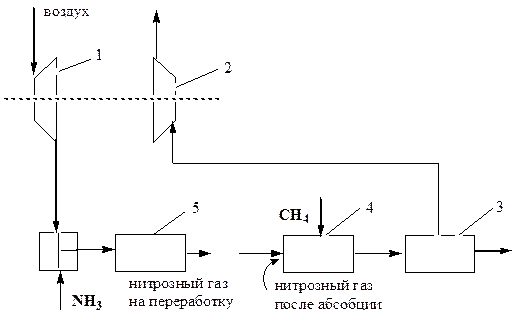
Pис.15. Принципиальная схема энергетического узла в ХТС производства азотной кислоты:
1- воздушный компрессор; 2- газовая турбина; 3- реактор каталитической очистки; 4- горелка; 5- контактный аппарат.
Передача энергии идёт механически, ибо компрессор (4) и турбина (5) находятся на одном валу. В этом производстве высокая температура отходящих газов используется для каталитической очистки отходящих газов от оксидов азота в реакторе(3).
В настоящее время химико - энергетические системы находят в промышленности всё более широкое использование.
3.2.4. Минимизация отходов - одно из решений для создания экологически безвредных производств.
Осуществление этой проблемы непосредственно связано с предыдущими тремя концепциями, и поэтому приведенные выше способы их реализации справедливы для создания безотходных производств.
Помимо этого имеются и свои специфические решения. К ним относятся: санитарная очистка и обезвреживание отходов, замкнутый водооборот и уменьшение вспомогательных потоков.
3.2. Оптимальное использование оборудования направлено на уменьшение затрат на аппаратуру и увеличение эффективности протекающего в ней процесса. Некоторые решения по реализации этой концепции:
1) Интенсификация процесса в аппарате за счет выбора нового процесса (например, использование более активного катализатора), оптимизация режима.
2) Интенсификация процесса в результате улучшения организации процесса в аппарате, что позволяет снизить диффузионные и тепловые сопротивления, а также увеличить движущую силу процесса.
Примером этого может служить организация газожидкостного процесса. Его можно организовать в барботажном реакторе, в колонне с насадкой и в реакторе в виде трубы, в котором с большой скоростью движется газожидкостной поток. Скорость массопередачи в двухфазном потоке системы зависят от диффузионных сопротивлений фаз, которые определяют величину коэффициента массопередачи - К, и удельной поверхностью массообмена (в единице объема реактора) - Sуд
Интенсивность процесса будет ограничена величиной b Sуд, Для указанных треx процессов эта величина не превышает следующих значений:
Способ организации: b Sуд
Барботаж 0,1- 0,2
Насадочная колонна до 0,5
газожидкостный поток в трубе до 1-1,2
Очевидно, если имеет место быстрая реакция, то необходима более интенсивная организация процесса, например, использование вместо барботажного реактора трубчатого с газожидкостным потоком.
3) Организацию технологического процесса покажем на примере узла санитарной очистки газов. Выше была приведена схема процесса с рекуперацией тепла. Она же обычно используется в процессах санитарной очистки газов (рис.16), где поток очищенного газа, например, в каталитическом реакторе (I), нагревается перед реактором в теплообменнике (2) за счет тепла газов, выходящих из реактора.

Рис. 16. Принципиальная схема ХТС санитарной очистки газов;
1 - каталитический реактор; 2 - теплообменник;
3 - горелка
При санитарной очистке газов, которые, как правило, содержат небольшое количество примеси, выделяется сравнительно немного тепла, и поэтому разность температур в теплообменнике мала. Это приводит к необходимости значительного увеличения поверхности теплообмена и таким образом увеличению размеров теплообменника.
В этом случае рационально частично вести подогрев газа, поступающего на катализатор, путем сжигания топлива в горелке 3. Это позволит уменьшить затраты на теплообменник.
4)Конструкционные решения направлены на выбор или создание менее материалоемкого оборудования.
5) Увеличение единичной мощности позволяет снизить удельные затраты на аппаратуру. Действительно, можно принять, что производительность П аппарата примерно пропорциональна его объему, где протекает процесс, т.е. пропорциональна его линейному размеру в кубе П~13, а затраты на аппарат примерно пропорциональны площади поверхности его корпуса, внутренних решеток и пр., т.е. Зап~12. Таким образом, удельные затраты будут составлять: Зап /П~П -1/3
Легко оценить, что удвоение мощности приводит к уменьшению удельных затрат на аппарат примерно на 20%. Это, грубая оценка. В действительности удвоение мощности приводит к уменьшению удельных затрат на 8 - 15 %.
4. АНАЛИЗ ХИИИКО-ТЕХНОЛОГИЧЕСКОЙ СИСТЕМЫ
4.1. Задачи анализа ХТС
Задачи анализа ХТС заключаются в получении сведений о функционировании системы в зависимости от принятой химической схемы, структуры технологических связей между элементами и подсистемами, а так же от конструкционных и технологических параметров, исходя из заданных свойств и показателей функционирования, имеющих оптимальное значение.
Для этого необходимы: а) технологический анализ ХТС - получение технологических показателей температуры, давления, размеров потоков, выхода и селективности, количества отходов и т.д.; б) технико-экономический анализ ХТС - получение экономических критериев оценки эффективности системы - расходных коэффициентов, затрат на производство продуктов и т.д. и, в конечном счете, получение сведений о себестоимости продукции; в) анализ функционирования системы - устойчивость, надежность, безопасность работы и др.
При этом необходимо учитывать, что ХТС обладает свойствами, не характерными для отдельных её элементов, это обусловлено взаимозависимостью режимов элементов.
Анализ ХТС осуществляется при разработке проектирования системы для определения её эффективности, а также для сравнения различных вариантов реализации процесса с целью выбора из них оптимального. Анализ используется и при модернизации и реконструкции действующих ХТС. Приведенные выше показатели работы ХТС находятся в результате решения систем уравнений материальных и тепловых балансов.
4.2. Материальные тепловые балансы химико-технологических систем
Балансы ХТС передают законы сохранения массы - материальные балансы и энергии - энергетические балансы, в частности тепловые балансы. Балансы ХТС составляются, как правило для стационарных процессов либо для ХТС в целом, либо для отдельных элементов или групп элементов. В последних случаях из схемы «вырезается» элемент или совокупность элементов (рис.17)
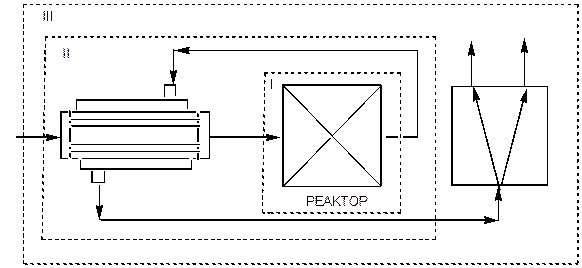 Рис. 17 к порядку расчёта ХТС
Рис. 17 к порядку расчёта ХТС
Выделены: 1- один элемент, 2-группа элементов;
3—ХТС в целом
Подобное выделение отдельных элементов или группы элементов ХТС дает информацию не только об эффективности ХТС в целом, но и её составляющих, что позволяет выявить "узкие места", варьировать параметры элементов или их совокупность и направленно осуществлять интенсификацию ХТС.
Материальный баланс основывается на том, что во всякой замкнутой системе масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате взаимодействия.
Например, в реактор поступают вещества, массы которых G1,G2,G3,... GS. В результате взаимодействия получают R продуктов с массой. G'1,G'2,G'3,... G'R Уравнение баланса такой системы будет
G1 + G2 + G3 +... GS = G'1 + G'2 + G'3 +... G'R
или
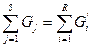 (IV 1a)
(IV 1a)
или 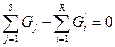 (IV.1б)
(IV.1б)
Тепловой баланс основан на том, что приход теплоты в данном процессе равен расходу её в том же процессе. Если принять, например, что в адиабатическом реакторе протекает экзотермическая реакция, то уравнение теплового баланса будет:
QP + G1H1 + G2H2 + G3H3 +... GSHS = G'1H'1 + G'2H'2 + G'3H'3 +... G'RH'R
или 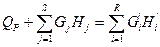 (IV.2a)
(IV.2a)
или 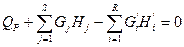 (IV. 2б)
(IV. 2б)
где Hj и H'i энтальпия веществ, поступивших в реактор и продуктов реакции соответственно
Qр- теплота химической реакции.
Уравнения (1V.1а),(1V.1б),(1V.2а),(1V.2б) справедливы для разомкнутых систем. Для замкнутых систем при составлении балансов учитывается наличие рециркуляции технологических потоков.
Тогда в соответствии с рис.11 уравнение баланса будет:
GП = G0 + GR (IV.3)
Соотношение потоков в системах с рециклом, как указывалось, учитывает коэффициент рециркуляции – KR и отношение рециркуляции -R. Тогда, поскольку
KR = GП/G0 и R = GR/GП
уравнение баланса принимает вид:
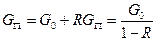 (IV.4a)
(IV.4a)
или  (IV.5)
(IV.5)
4.2.1. Балансовое соотношение
Для составления балансов используются стехиометрические, термохимические, термодинамические и межфазовые соотношения.
Стехиометрические балансовые соотношения отражают количественные изменения состава системы. Например, в реакции:
2С + О2 = 2СО
Из трех молей исходных веществ (углерода и кислорода) получается два моля продукта (оксида углерода). Это учитывается при составлении балансов с помощью стехиометрических коэффициентов
Реагирующие компоненты обозначаются как G1, G2,.....,Gi.
Если в смеси имеется S веществ, то J= 1,2....... S. При переносе всех символов в одну часть химического уравнения баланса оно принимает вид:
ν 1G1 + ν2 G2 +… νSGS = 0 (1V.6а)
где принято для исходных веществ n >0, для продуктов реакций n<0.
Для приведенной выше реакции n=+2, n=+1, n=-2.
Уравнение (1V.6а) записывается в виде:
 (1V,6б)
(1V,6б)
Это уравнение называется стехиометрическим уравнением реакции в
алгебраической форме
Если в системе протекает несколько реакций, например - R с участием S - компонентов, то уравнение (1У.66) запишется следующим образом
 (IV.7)
(IV.7)
где i –1.2.3…..R; j = 1,2,3 …S, n- стехиометрический коэффициент j –го вещества в i - ой реакции.
Для расчета сложной системы следует использовать минимальное количество уравнений химических реакций, которые отражают количественные изменения системы или состава реагирующей смеси. Исходя из этого необходимо определить какие из реакций стехиометрически зависимы и какие независимы.
Стехиометрически зависимыми химическими реакциями называются такие, стехиометрические уравнения которых могут быть получены как линейные комбинации других стехиометрических уравнений из числа рассматриваемых R - уравнений реакций.
Стехиометрически независимыми называют реакции, ни одно стехиометрических уравнений которых не может быть получено путем линейной комбинации других, и набор этих R уравнений достаточен для
полного и однозначного описания ХТС
Термодинамические балансовые соотношения, поскольку балансы составляются для стационарных состояний, дают возможность количественного определения равновесных составов реакционных смесей.
Для этого необходимо определение величину изобарно-изотермического потенциала в соответствии с уравнением Гиббса:
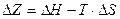 (IV.8)
(IV.8)
где Н - энтальпия системы; Т - температура; S - энтропия. Это позволят, во-первых, судить о наиболее вероятном пути протекания реакций и, во-вторых, количественно определить равновесный состав реакционной смеси, исходя из константы равновесия реакции, которая может быть найдена из уравнения:
 (IV.9.)
(IV.9.)
где Z0 - изменение стандартного изобарно-изотермического потенциала; R - газовая постоянная; К - константа равновесия, а также из уравнения:
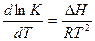 (IV.10.)
(IV.10.)
Термохимические балансовые соотношения дают сведения об изменении энтальпии при протекания химических реакций в отдельных элементах или во всей ХТС в целом. В конечном счете - о количестве теплоты, выделяющейся при экзотермических реакциях и поглощаемой при эндотермических реакциях, что определяет выбор режимов аппаратуры и структуры ХTC.
Межфазовые балансовые соотношения дают свеаденая о равновесии в гетерогенных системах. Для этого используются правило фаз, законы распределения веществ между фазами, диаграммы фазового равновесия, которые позволяют найти состав фаз я их свойства: агрегатное состояние, температура плавления, кипения, упругость паров и др. Необходимо отметить, что термохимические, термодинамические и межфазовые балансовые соотношения используются только для анализа протекания стехиометрических независимых реакций.
В результате решения приведенных выше балансовых соотношений получают данные, необходимые для составления материальных и тепловых балансов отдельных элементов и ХТС в целом. Такие балансы часто называют энтальпийными, поскольку в них для определения состава реакционных смесей, количество поглощенного или выделенного тепла, в соответствие с первым законом термодинамики исходят из изменения энтальпии системы.
4.3. Примеры балансов
Балансы могут быть оформлены в виде сводных таблиц, в левой части которых перечислены, а затем просуммированы все статья прихода, в правой - все расходные статьи. Подобные таблицы приводятся как для отдельных элементов, так и для XTС в целом.
4.3.1. Материальный и тепловой балансы узла окисления аммиака в производстве азотной кислоты, состоящего яз контактного аппарата я котла-утилизатора.
В контактном аппарате протекает необратимая экзотермическая реакция:
4NНз + 5 O2 = 4NО + 6 H2O + Q
Котел-утилизатор устанавливается с целью использования теплоты реакции для производства пара. В нем может происходить частичное окисление NО в NО 2
Таблица 1 Материальный баланс (составлен на 1т 100 % HNO3)
| Приход | Расход | ||||
| № | статья | кг/т HNO3 | № | статья | кг/т HNO3 |
| Аммиак Воздух О2 N2 Влага воздуха Вода | Нитрозные газы: NO2 NO N2 O2 H2O пар Пар | ||||
| Всего: | 5 617 | Всего: | 5 617 |
Достоинством представления балансов в форме таблиц является их простота, наглядность, возможность непосредственного контроля результатов и их использования для определения показателей процесса. Другим способом является графическое оформление результатов балансов в виде диаграмм, наглядно передающие соотношение между отдельными статьями приходной и расходной частей баланса.
Для быстрого обозрения результатов баланса по отдельным элементам ХТС удобно нанесение на структурную технологическую схему ХТС значений материальных и энергетических потоков.
Таблица 2 Тепловой баланс
| Приход | Расход | ||||
| № | статья | кДж/т HNO3 | № | статья | кДж/тHNO3 |
| С азотно-воздушной смесью Теплота реакции окисления аммиака (в контактном аппарате) Теплота реакции окисления NO и NO2 (в котле-утилизаторе) | 635,36 3883,22 638,286 | С газами (на выходе из котла –утилизатора) На производство пара В окружающую среду | 1390,696 3678,4 87,78 | ||
| Всего: | 5156,866 | Всего | 5156,866 |
4.3.2. Материальный баланс установки термического крекинга газойля (замкнутая система), перерабатывающей 470 т газойля в сутки. При установившемся состоянии из печи крекинга выводятся реакционная смесь, содержащая, масс.%: газа- 4,25; бензина- 17,73; рециркулята- 66,67; крекинг- остатка- 11,35.
В данном случаe решается задача определения количества получаемых продуктов и производительность печи.
Решение: Массовая доля поступившего в реактор сырья от загрузки реактора составляет:
C = G0/GП (1V.П)
следовательно:
КR = 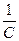 (IV.12)
(IV.12)
Если обозначить через Сп массовую долю (масс. %} продукта, содержащегося в реакционной массе, выходящей из реактора, а через Со – от количества подаваемого свежего сырья, то материальный баланс выражается уравнением:
C0 = KRCП (1У.13)
Коэффициент рециркуляции зависит от отношения рециркуляции,
которое будет:

Откуда

Масс.доля (%) продуктов по свежему сырью составит, %:
Сгаз= 3•4,25 = 12,75
C бенз.=2•17,73 = 53,19
Сост=3• 11,35 =34,05
Отсюда количество получаемых продуктов, т / сут.;
газ: 470 •12,75=60
бензин: 470• 53,19 = 250
остаток: 470 • 34,05 =160
Таблица 3 Материальный баланс установки крекинга
| № | Приход | № | Расход | ||
| статья | т/сут | статья | т/сут | ||
| газойль | Газ Бензин остаток | ||||
| Всего: | Всего; |
Производительность печи:
GП = КRG0, = 3∙470 = 1410 т/сут.
Из приведенных примеров следует, что результаты балансов позволяют рассчитать: расходные коэффициенты, состав и количество получаемых продуктов реакций, выход продуктов, селективность, материальные и энергетические потери или, в конечном счёте, степень использования сырья и энергии, характеризуемую энергетическим коэффициентом (энергетический к.п.д.), который равен:
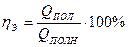 (IV.14)
(IV.14)
где Qпол - полезно затрачиваемая теплота, на осуществление целевой реакции,
Qполн - суммарный расход теплоты.
В приведенном выше примере теплового баланса окисления аммиака (табл. 2) полезно используемой является теплота идущая на производство пара. Следовательно, в этом случае энергетический к.п.д. составляет:
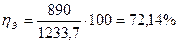
Однако энергетический к.п.д., получаемый из энтальпийного баланса, не достаточен для оценки эффективности процесса, поскольку он не всегда вскрывает потенциальные возможности системы.
4.4. ОСНОВНЫЕ ПОНЯТИЯ ЭКСЕРГИТИЧЕСКОГО АНАЛИЗА ХТС
Информацию, позволяющую более полно обосновать выбор процесса и провести его сравнение с другими, можно получить при применении наряду с энтальпическим, термодинамического анализа, в часности эксергетического.
Эксэргия характеризует полезную работу, которую может совершить система в соответствии со вторым законом термодинамики, согласно которому не все процессы могут протекать в направлении, обратном его естественному ходу. Или, что то же, эксэргия - это энергия, которая при участии заданной окружающей среды, может быть преобразована в другую форму энергии.
Использование эксэргии дает возможность при оценке и сравнении эффективности различных процессов учесть не только количество потоков энергии, но и их качество, т.е. способность энергии к совершению полезной работы.
Удельная эксэргия потока вещества, всходя из второго закона термодинамики, будет:
e = H – H0 - T0(S – S0) (IV.15)
где Н,S - энтальпия и энтропия вещества в анализируемом состоянии. соответственно;
H0, S0~ энтальпия и энтропия вещества в состоянии термодинамического равновесия с окружающей средой, соответственно
Т0- температура окружающей среды.
Из уравнения (IV.15) следует, что величина эксэргии находится с помощью известных параметров состояния - энтальпии и энтропии.
При этом потери эксэргии в адиабатной системе определяются произведением температуры окружающей среды на приращение энтропии вследствие необратимости процесса. Они будут равны:.
∆e = T0(S – S0) (IV.16)
В качестве примера можно принять теплопередачу и установить для этого процесса зависимость потери эксэргии от температуры. Предположим, что теплый поток А передает тепловую энергию холодному потоку В. Количество передаваемой теплоты для элементарного участка теплообменника будет dQ. Из уравнения (1V. 16) учитывая, что S=Q/T, следует, поток А с количеством теплоты передает поток эксэргии, равный
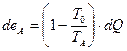 (IV.17)
(IV.17)
Холодный поток получает только часть этой величины
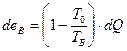 (1V.18)
(1V.18)
Разница, или что то же потеря эксэргии составит:
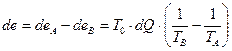 (IV.19)
(IV.19)
или
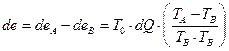 (IV.20)
(IV.20)
Уравнение (1У.20) показывает, что потеря эксэргии зависит не только от конечной разности температур, но так же от температурного уровня теплопередачи. Весьма интересно, что потери эксергии при той же разности температур при высокой температуре много меньше, чем при низкой. Поэтому, с энергетической точки зрения, выгодно вести процессы при высоких температурах, так как в этом случае допустимы значительно большие разности температур, чем при температурах низких.
Критерием термодинамической эффективности процесса служит эксергетический коэффициент полезного действия, который в общем виде может быть представлен как:
 (IV.21)
(IV.21)
где  -произведенная эксергия
-произведенная эксергия
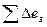 - затраченная эксергия
- затраченная эксергия
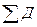 -потери эксергии
-потери эксергии
Значения эксергетического и энергетического к.п.д., как правило, не совпадают.
Так, например, энтальпийный анализ показал, что энергетический к.п.д. узла окисления аммиака в производстве азотной кислоты составляет 72,I4 %.
Для этого же процесса эксергетический к.п.д. рассчитанный по уравнению (1V.21)
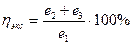
где е1 – эксергия входящей в аппарат газовой смеси- 63,83х10 ⁵ кДж/т HNО3;.
е2- эксэргия нитрозных газов выходящих из котла утилизатора – 21,36 х 105 кДж/т HNO3,
е3 - эксергяя пара – 11,83 х105 кДж/т НNO3 составит:
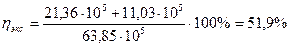
Таким образом, проведенный эксергетический анализ свидетельствует, что для интенсификации процесса имеются ресурсы большие, чем это следует из анализа энтальпического.
Следовательно, эксергетический анализ дает возможность оценки совершенства процессов и показывает границы их улучшения.
Полученные в результате анализа XTС сведения о материальных и тепловых нагрузках аппаратов системы, эффективности их использования позволяют количественно оценить различные варианты и подойти к созданию систем, в которых наилучшим образом одновременноииспользуется сырье, оборудование и энергия.
В настоящее время наиболее эффективно решается проблема использования энергии в энерготехнологических системах, для которых характерна строгая сбалансированность производства и потребления энергии, основанная на использовании теплоты экзотермических реакций и вторичных энергетических ресурсов.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Кафаров В.В., Перов В.Л., Мешалкин В.П. Принципы математического моделирования химико- технологических систем. – М.: Химия, 1976.- 344с.
2. Бретшнайдер С., Кавецкий В., Лейко Я., Марцинковский Р. Общие основы химической технологии. - М.: Химия, 1977- 504 с.
3. Нагиев И.Ф. Теория рециркуляции и повышение оптимальности химических процессов. – М.: Наука, 1970- 390 с.
|
|
|
|
|
Дата добавления: 2014-12-07; Просмотров: 1492; Нарушение авторских прав?; Мы поможем в написании вашей работы!