
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Температура
|
|
|
|
Температура макроскопиялық жүйелердің термодинамикалық тепе-теңдік күйін сипаттайды. Ал макроскопиялық жүйенің әр бөлігінің температурасы түрліше болса, онда оның бір бөлігінен екінші бөлігіне энергия тасымалданады. Демек, температура – макроскопиялық жүйе бөлшектерінің жылулық қозғалысының интенсивтілігін көрсететін шама болып табылады. Температураны анықтаудың кез-келген әдісі температуралық шкаланы таңдауды қажет етеді. Температураны өлшеу тек жанама өлшеу арқылы мүмкін, яғни температураны денелердің физикалық қасиеттерінің температураға тәуелділіктерін қолдану арқылы анықтауға болады. Мысалы: денелердің температуралары өзгергенде олардың ұзындықтары, көлемі, тығыздықтары, серпімді қасиеттері, электрлік кедергісі және т.б. қасиеттері өзгереді. Денелердің осы қасиеттерінің кез-келгенінің өзгеруі температураны өлшеудің негізі болып табылады. Ол үшін термометрлік дене деп аталатын дене үшін қарастырылатын қасиетінің температураға функциональдық тәуелділігі белгілі болуы қажет. Халықаралық жүзградустық температуралық шкаласында температура Цельсий градусы (С0) түрінде өрнектеледі және  -арқылы белгіленеді. Бұл жағдайда қалыпты атмосфералық қысымда мұздың еру және судың қайнау температурасы сәйкесінше 0 және 100 0С-қа тең деп алынады. Термодинамикалық температуралық шкалада температура Кельвин түрінде өрнектеледі және Т арқылы белгіленеді. Термодинамикалық температура Т мен Цельсий шкаласындағы температура
-арқылы белгіленеді. Бұл жағдайда қалыпты атмосфералық қысымда мұздың еру және судың қайнау температурасы сәйкесінше 0 және 100 0С-қа тең деп алынады. Термодинамикалық температуралық шкалада температура Кельвин түрінде өрнектеледі және Т арқылы белгіленеді. Термодинамикалық температура Т мен Цельсий шкаласындағы температура  арасындағы байланыс келесі түрде беріледі:
арасындағы байланыс келесі түрде беріледі:
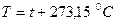
 температурасы (Цельсиий шкаласындағы
температурасы (Цельсиий шкаласындағы  ) абсолют ноль температура немесе термодинамикалық шкала бойынша ноль деп аталады.
) абсолют ноль температура немесе термодинамикалық шкала бойынша ноль деп аталады.
§8.Газ заңдары. Изопроцестер
Термодинамикалық процесс деп қарастырылатын термодинамикалық жүйенің параметрлерінің өзгеруімен сипатталатын жүйенің күйінің өзгеруін айтады.
Берілген жағдайда атомдарының арасындағы өзара әсерлесу күші елеусіз аз болатын газды идеал газ деп атайды.
Қалыпты жағдайдағы газдарды идеал газ деп есептеуге болады. Термодинамикалық параметрлер арасындағы байланысты анықтайтын теңдеуді күй теңдеуі деп атайды.
 .
.
1. Изотермиялық процесс:
Тұрақты температурада өтетін процесс изотермиялық процесс деп аталады.
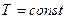 .
.
Изотермиялық процесті сипаттайтын заңды ағылшын ғалымы Бойль мен француз ғалымы Марриот бір-бірінен тәуелсіз, тәжірибе жүзінде алды. Сондықтан бұл заң Бойль-Мариот заңы деп аталады.
Берілген газдың массасы үшін тұрақты температуда газ қысымының көлемге көбейтіндісі тұрақты болады.
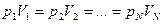 немесе
немесе 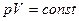
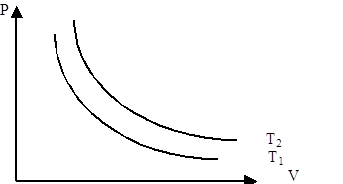
Изотермиялық процесті сипаттайтын графикті изотерма деп атайды. Графикте Т1<Т2.
2. Изобаралық процесс:
Тұрақты қысымда өтетін процесс изобаралық процес деп аталады.
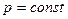 .
.
Изобаралық процесті сипаттайтын заңды француз ғалымы Гей-Люссак тәжірибе жүзінде алды. Сондықтан бұл заң Гей-Люссак заңы деп аталады.
Берілген газдың массасы үшін тұрақты қысымда газ көлемінің температуға қатынасы тұрақты болады.
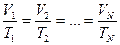 немесе
немесе 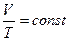 .
.
Гей-Люссак заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
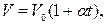
мұндағы: 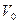 -
- 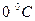 температурадағы газ көлемі,
температурадағы газ көлемі, 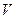 -
-  температурадағы газ көлемі,
температурадағы газ көлемі, 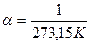 - газ көлемінің ұлғаюының температуралық коэффициенті.
- газ көлемінің ұлғаюының температуралық коэффициенті.
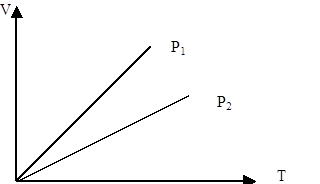
Изобаралық процесті сипаттайтын графикті изобара деп атайды. Графикте р1<р2.
3. Изохоралық процесс:
Тұрақты көлемде өтетін процесті изохоралық процесс деп аталады.
 .
.
Изохоралық процесті сипаттайтын заңды француз ғалымы Шарль тәжірибе жүзінде алды. Сондықтан бұл заң Шарль заңы деп аталады.
Берілген газдың массасы үшін тұрақты көлемде газ қысымының температуға қатынасы тұрақты болады.
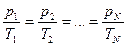 немесе
немесе 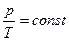 .
.
Шарль заңын Цельсий шкаласындағы температураны пайдаланып келесі түрде жазылады:
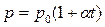 ,
,
мұндағы: 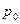 -
- 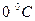 температурадағы газ қысымы,
температурадағы газ қысымы, 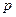 -
-  температурадағы газ қысымы,
температурадағы газ қысымы, 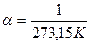 - газ қысымының температуралық коэффициенті.
- газ қысымының температуралық коэффициенті.
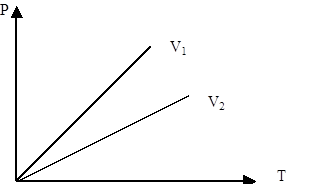
Изохоралық процесті сипаттайтын графикті изохора деп атайды. Графикте V1<V2.
8.1.Авогадро заңы
Температуралары және қысымдары бірдей кез-келген газдардың бір молінің көлемдері де бірдей болады.
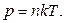
Қалыпты жағдайда ( ) кез-келген газдың 1 м3 көлемінде
) кез-келген газдың 1 м3 көлемінде 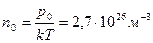 молекула болады. Бұл сан Лошмидт саны деп аталады.
молекула болады. Бұл сан Лошмидт саны деп аталады.
8.2.Клапейрон теңдеуі
1834 жылы фрацуз ғалымы Клапейрон Бойль-Мариот және Гей-Люссак заңдарын біріктіре отырып, (р,Т,V) параметрлерінің үшеуі де өзгергенде жүретін процестерді сипаттайтын теңдеуді алды. Бұл теңдеу Клапейрон теңдеуі деп аталады.

8.3.Идеал газ күйінің теңдеуі
Орыс ғалымы Д.И. Менделеев Клайперон және Авогадро заңдарын біріктіре отырып идеал газ күйінің теңдеуін алды:

мұндағы: R-универсал газ тұрақтысы, R= 8,31 Дж/(моль·К).
Бұл теңдеу кейде Менделеев-Клапейрон теңдеуі деп аталады.
8.4.Дальтон заңы
Қоспа газдардың қысымын Дальтон заңының көмегімен анықталады:
Қоспа газдардың қысымы қоспаны құрайтын жеке газдардың парциаль қысымдарының қосындысына тең болады:
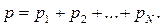
Парциаль қысым деп қоспадағы басқа газдардың қысымын ескермеген жағдайдағы жеке газдардың түсіретін қысымын айтады.
Қоспа газдарға Менделеев-Клапейрон теңдеуін қолдануға болады.
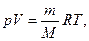
мұндағы: 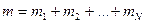 - қоспа газдың толық массасы,
- қоспа газдың толық массасы, 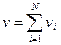 - қоспа газдың зат мөлшері,
- қоспа газдың зат мөлшері,  қоспа газдың мольдік массасы,
қоспа газдың мольдік массасы,  - қоспа газдағы жеке газдардың үлесі.
- қоспа газдағы жеке газдардың үлесі.
§ 9.Газдардың молекула-кинетикалық теориясы
Газдардың физикалық қасиеттерін зерттеуге статистикалық әдісті қолданайық.
Молекула –кинетикалық теорияның негізгі қағидалары:
1. Барлық заттар бөлшектерден тұрады (молекулалар мен атомдардан);
2. Осы бөлшектер тәртіпсіз, хаостық қозғалыста болады. Бұл қозғалыс жылулық қозғалыс деп аталады;
3. Бөлшектер бір-бірімен өзара әсерлеседі.
Зат бөлшектерінің жылулық қозғалысын қөрнекі түрде көрсететін тәжірибені ағылшын ғалымы Броун жасады. Броун микроскоптың көмегімен сұйықта қалқыған гүл тозаңдарының жылдам, тәртіпсіз қозғалысын бақылады. Осындай зат бөлшектерінің жылулық қозғалысын Броундық қозғалыс деп атайды.

9.1.Молекула –кинетикалық теорияның негізгі теңдеуі
Макроскопиялық параметрлердің (қысым, көлем) микроскопиялық параметрлермен (молекулалардың массасы, жылулық қозғалыс жылдамдығы, кинетикалық энергиясы) арасындағы байланысты көрсететін өрнекті молекула-кинетикалық теорияның негізгі теңдеуі деп атайды.
Молекулалардың орташа жылдамдығы:

өрнегімен анықталады.
Молекулалар концентрациясы - 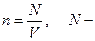 молекулалар саны. Концентрация деп бірлік көлемдегі бөлшектер санын айтамыз. Өлшем бірлігі
молекулалар саны. Концентрация деп бірлік көлемдегі бөлшектер санын айтамыз. Өлшем бірлігі 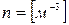 .
.
Бір бағытта қозғалатын бөлшектер саны- 


Соныменен 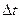 -уақытта ауданы S-қабырғаға соқтығысатын молекулалар саны-
-уақытта ауданы S-қабырғаға соқтығысатын молекулалар саны-

Әрбір молекула қабырғаға F1-күшпен әсер етеді: 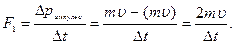
Соқтығысатын барлық молекулалардың қабырғаға әсер ететін қысым күші: 
Әр түрлі молекулалардың түрліше 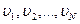 жылдамдықтармен қозғалатынын ескерсек, өрнекке молекулалардың жылдамдығының квадратының орташа мәні койылады.
жылдамдықтармен қозғалатынын ескерсек, өрнекке молекулалардың жылдамдығының квадратының орташа мәні койылады.
Молекулалардың орташа квадраттық жылдамдығы:
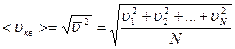 .
.
Қысым күштің күш әсер ететін ауданына қатынасымен анықталады:
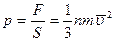 немесе
немесе 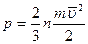 ,
,
осыдан  екенін анықтаймыз,
екенін анықтаймыз,
мұндағы: 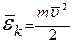 - газ молекуласының ілгерлемелі қозғалысының кинетикалық энергиясының орташа мәні.
- газ молекуласының ілгерлемелі қозғалысының кинетикалық энергиясының орташа мәні.
Осы алынған өрнекті молекула-кинетикалық теорияның негізгі теңдеуі немесе Клаузиус теңдеу і деп атайды.
Газдың қысымы газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясына тура пропорционал болады.
Температураның негізгі физикалық мағынасын көрсететін өрнек- 
мұндағы- 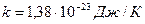 Больцман тұрақтысы деп аталады.
Больцман тұрақтысы деп аталады.
Температура газ молекуласының орташа кинетикалық энергиясының сандық мөлшері болып табылады. Больцман тұрақтысы температура 1 Кельвинге өзгергенде газ молекуласының орташа кинетикалық энергиясы қаншаға өзгеретінін көрсетеді.
9.2.Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерлемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:

Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір атомды газ үш бағытта ілгерлемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі 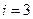 -ке тең.
-ке тең.
Екі атомды газ үш бағытта ілгерлемелі және екі бағытта айналмалы қозғала алады (сурет). Сондықтан екі атомды газдың еркіндік дәрежесі 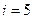 -ке тең болады.
-ке тең болады.

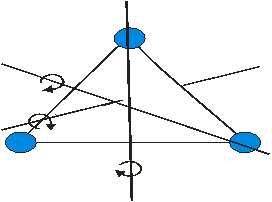
2-атомды газ үшін 3-атомды газ үшін
Үш атомды газ үш бағытта ілгерлемелі және үш бағытта айналмалы қозғала алады Сондықтан үш атомды газдың еркіндік дәрежесі  -ға тең болады.
-ға тең болады.
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 2804; Нарушение авторских прав?; Мы поможем в написании вашей работы!