
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Требования к качеству воды для капельного полива, методика корректировки питательного раствора в зависимости от состава воды
|
|
|
|
При использовании капельного полива качество воды является одним из основных факторов, обеспечивающих успех тепличного производства. Поэтому так важно знать химический состав используемой в хозяйстве воды. Это необходимо, как для расчета количества солей и кислот в питательном растворе, так и при его коррекции. В каждом тепличном комбинате используемая поливная вода имеет определенный химический состав, что следует учитывать еще на стадии проектирования систем капельного полива, с учетом пригодности конкретной воды.
Различная по происхождению вода представляет собой сложный раствор, содержащий все известные химические элементы в виде простых и сложных ионов, комплексных соединений, растворенных или газообразных молекул, стабильных и радиоактивных изотопов, а также определенный бактериальный состав.
Сложность состава определяется присутствием большого числа химическиx элементов, различным содержанием и разнообразием форм каждого из них.
В воде отмечается 6 основных групп химических компонентов:
1) главные ионы (макроэлементы) К+, Nа+, Мg2+, Са 2+, С1-1; S042.
НСО3 -1,СО2 --
2) растворенные газы — кислород, азот, сероводород, углекислота;,
3) биогенные вещества — соединения N, Р, Fе, Si;
4) органические вещества — органические кислоты, сложные эфиры,
фенолы, гумусовые вещества;
5) микроэлементы;
6) загрязняющие вещества.
Суммарное содержание минеральных веществ называется минерализацией воды, которая выражается в мг/дм3, г/дм3, г/кг, % (промилле (от лат. Рго mille — за тысячу) тысячная часть числа, обозначается — %).
По степени минерализации вода бывает пресной до 1%, солоноватой (1—25%). соленой (25—50%), очень соленой (более 50%). Для капельного орошения лучше использовать воду с содержанием минеральных веществ до 0,5—1%.
Повышенное поступление солей с поливной водой приводит к засолению субстратов, что отрицательно сказывается на продуктивности растений. Томаты более солеустойчивы, чем огурцы, но на засоленных субстратах сильнее поражаются вершинной гнилью.
Химический состав воды для приготовления питательных растворов не должен превышать величины указанной в таблице 7.4.
На основе химического состава воды проводится коррекция питательного раствора. Существует правило, по которому концентрация элементов в поливной воде не должна превышать их содержание в стандартных питательных растворах. Особенно это касается микроэлементов, так как выращивание растений в ограниченном корневом объеме может привести к их накоплению и отравлению растений или к явлениям антагонизма элементов.
Питательный раствор обязательно корректируется на содержание присутствующих в воде К, Са, Мg, S042-, NO3-. Реакция его доводится до оптимального уровня рН, который для большинства культур составляет 5,5-6,0.
Так как вода чаще всего слабощелочная или щелочная для снижения рН использую ортофосфорную (Н3РО4) или азотную (НNО3) кислоты.
Количество кислоты рассчитывается по содержанию бикарбонатов (НСО3 -).
В принципе на 1 мМоль НСО3 - в воде нужен 1 мМоль кислоты. Однако в нейтрализации участвуют не все бикарбонаты, поэтому для обеспечения буферности раствора оставляют 1 мМоль НСО3= 61 мг без нейтрализации 0,5-1 мМоль/л.
Кислоты и бикарбонаты взаимодействуют в эквивалентных количествах:
1 мМ НСО3 - = 61 мг/л
1 мМ Н3РО4, = 98 мг/л
1 мМ НNO3, = 63 мг/л
Н3РО4, + НСО3 = Н2РО4+ Н20 + СО2
NN03+ НСО3 = N03- + Н20 + СО2
В практике используют разбавленные кислоты и соответственно расходуют их в большем количестве раствора. Для расчета необходимого количества кислоты можно использовать следующие формулы:
Для ортофосфорной кислоты:
A1 = а х 98/61 х 100/К,
где А1 — количество ортофосфорной кислоты (мг/л), а — количество нейтрализуемых бикарбонатов (мг/л), К — концентрация применяемой кислоты (%).
Для азотной кислоты:
А2 = а х 63/61 х 100/К,
где А2 — количество азотной кислоты (мг/л), а — количество нейтрализуемых бикарбонатов (мг/л), К — концентрация применяемой кислоты (%).
Пример:
Необходимо нейтрализовать 2,4 мМ НСО3 - (146 мг/л).
1,5 мМ нейтрализуем ортофосфорной кислотой и 0,9 мМ — азотной.
1,5 мМ/л х 61 = 91,5 мг/л — количество бикарбонатов, которые требуется нейтрализовать ортофосфорной кислотой; (однако количество используемой ортофосфорной кислоты ограничено нормой Р в рабочем растворе, поэтому остальное количество бикарбонатов нейтрализуют обычно азотно кислотой)
0,9 мМ/л х 61 мг/л = 54,9 мг/л — количество бикарбонатов, которые требуется нейтрализовать азотной кислотой.
В хозяйстве имеется 65%-ная ортофосфорная кислота и 59%-ная азотная. Рассчитываем их количество по приведенным формулам.
Для Н3РО4:
А1 = 91,5 х 98/61 х 100/65 = 226 мг/л.
Для NN03,:
А1 = 54,9 х 63/61 х 100/59 = 96 мг/л.
Для приготовления 1000 л маточного раствора, в 100 раз более концентрированного, чем рабочий, нужно взять:
65%-ной ортофосфорной кислоты — 226 мг х 1000 х 100 = 22,6 кг;
59%-ной азотной кислоты — 96 мг х 1000 х 100 = 9,6 кг.
Для перевода массы кислот в литры необходимо знать их плотность.
Чтобы легче регулировать рН рабочего раствора крепкие кислоты нужно
предварительно разбавлять в 5—10 раз.
Пример коррекции питательного раствора:
Необходимо приготовить стандартный питательный раствор для культу-
ры томата на торфе (табл. 7.3): рН = 5,5, ЕС = 2,7 мСм/см.
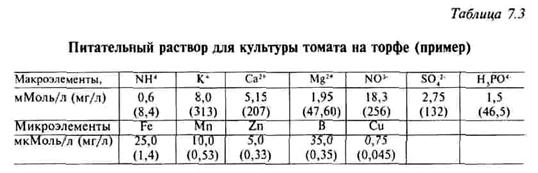
Имеется анализ воды (табл. 7.3): ЕС == 0,4 мСм/см; рН = 7,3; содержание бикарбонатов 3,4 мМоль/л.
По данным анализа можно сделать вывод, что эта вода пригодна для капельного полива, так как содержание солей небольшое — 0,4 мСм/см. По составу вода гидрокарбонатно-кальциевая, по величине рН — нейтральная.
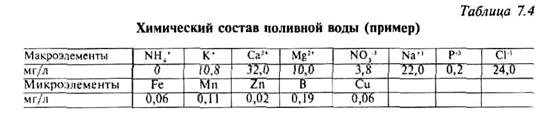
Для приготовления питательного раствора следует сделать корректировку (необходима нейтрализация бикарбонатов с целью снижения рН), учесть содержание в поливной воде кальция, магния и других элементов. Данные по количественному составу воды для проведения расчетов следует перевести в моли и микромоли.

Таким образом, в данном случае корректировка касается в основном бикарбонатов, кальция, магния, бора. Раствор готовят из имеющихся в хозяйстве удобрений, в нашем случае для приготовления 1 м3 рабочего раствора необходимо разбавление в 100 раз маточного раствора.
В зависимости от периода вегетации и возделываемой культуры, суточная потребность в воде может составлять от 0,3 л до 3 л на растение. Следует помнить, что нормирование подачи воды, очень ответственный момент в технологии малообъемного выращивания овощей с капельным поливом. 
|
|
|
|
|
Дата добавления: 2014-12-27; Просмотров: 3586; Нарушение авторских прав?; Мы поможем в написании вашей работы!