
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ динамики коэффициента соотношения между темпами роста производительности труда и его оплатой. 1 страница
|
|
|
|
Вариант
Класс
Вариант
Класс
2, 5, 6, 7
Вариант
Класс
6, 3, 2, 1
Вариант
Класс
Вариант
Класс
Вариант
Класс
Вариант
Класс
Вариант
Класс
Государственный контроль и надзор за соблюдением обязательных требований технических регламентов.
Идентификация объектов.
Идентификация продукции – это процедура, которая позволяет установить соответствие конкретной однородной продукции, подлежащей подтверждению соответствия стандартам, нормам, ГОСТам, требованиям, предъявляемым к данной модели, типу (виду) продукции в нормативной и нормативно-технической документации или другой информации по продукции (товару). Основное понятие продукции – это результат труда, добытый или изготовленный человеком для удовлетворения общественных или личных потребностей. Продукция в сертификации – это объект подтверждения соответствия ее потребительских качеств и безопасности.
Идентификация бывает потребительская, товарно-партионная, видовая или ассортиментная, сортовая, качественная и специальная. При любом виде идентификации самым основным источником является маркировка и этикетка продукции, нормативные документы (ТУ, ТО, ГОСТы), различная техническая документация, товарно-сопроводительные документы.
Идентифицировать продукцию необходимо по параметрам, признакам, показателям и требованиям к конкретной группе продукции и которых достаточно для подтверждения соответствия, что и будет являться основание для выдачи разрешительного документа на определенный срок и по выбранной схеме. Методами идентификации можно считать действия компетентных органов, аккредитованных в системе сертификации РФ, направленные на определение принадлежности продукции к конкретной группе продукции по кодам ОКП, наименования продукции, области применения и предотвращение введения потребителя в заблуждение в период реализации и эксплуатации. К методам идентификации относится: экспертиза и проверка документов, визуальный осмотр, органолептический метод, испытания, Результат идентификации – это заключение, подписанное экспертом в установленном законом порядке. Заключение оформляется на специальном бланке и подписывается экспертом, который имеет свидетельство компетентности на данный конкретный вид продукции. Практическое применение идентификации продукции отражено в разрешительном документе. Это - сертификат или декларация ГОСТ Р, сертификат соответствия или декларация техническому регламенту России или Таможенного союза.
|
|
|
Органы государственного контроля (надзора) за соблюдением требований технических регламентов.
1. Государственный контроль (надзор) за соблюдением требований технических регламентов осуществляется федеральными органами исполнительной власти, органами исполнительной власти субъектов Российской Федерации, уполномоченными на проведение государственного контроля (надзора) в соответствии с законодательством Российской Федерации (далее - органы государственного контроля (надзора).
2. Государственный контроль (надзор) за соблюдением требований технических регламентов осуществляется должностными лицами органов государственного контроля (надзора) в порядке, установленном законодательством Российской Федерации.
Объекты государственного контроля (надзора) за соблюдением требований технических регламентов.
1. Государственный контроль (надзор) за соблюдением требований технических регламентов осуществляется в отношении продукции или в отношении продукции и связанных с требованиями к продукции процессов проектирования (включая изыскания), производства, строительства, монтажа, наладки, эксплуатации, хранения, перевозки, реализации и утилизации исключительно в части соблюдения требований соответствующих технических регламентов.
|
|
|
2. В отношении продукции государственный контроль (надзор) за соблюдением требований технических регламентов осуществляется исключительно на стадии обращения продукции.
3. При осуществлении мероприятий по государственному контролю (надзору) за соблюдением требований технических регламентов используются правила и методы исследований (испытаний) и измерений, установленные для соответствующих технических регламентов в порядке, предусмотренном пунктом 11 статьи 7 настоящего Федерального закона.
4. Изготовитель (лицо, выполняющее функции иностранного изготовителя) впервые выпускаемой в обращение продукции вправе обратиться в орган государственного контроля (надзора) с обоснованным предложением об использовании при осуществлении государственного контроля (надзора) правил и методов исследований (испытаний) и измерений, применяемых изготовителем (лицом, выполняющим функции иностранного изготовителя) при подтверждении соответствия такой продукции и не включенных в перечень документов в области стандартизации, содержащий правила и методы исследований (испытаний) и измерений, в том числе правила отбора образцов, необходимые для применения и исполнения принятого технического регламента и осуществления оценки соответствия.
Орган государственного контроля (надзора) рассматривает предложение изготовителя (лица, выполняющего функции иностранного изготовителя) впервые выпускаемой в обращение продукции об использовании при осуществлении государственного контроля (надзора) применяемых изготовителем (лицом, выполняющим функции иностранного изготовителя) при подтверждении соответствия такой продукции правил и методов исследований (испытаний) и измерений и в течение десяти дней со дня получения указанного предложения направляет изготовителю (лицу, выполняющему функции иностранного изготовителя) свое решение.
В случае отказа от использования при осуществлении государственного контроля (надзора) применяемых изготовителем (лицом, выполняющим функции иностранного изготовителя) при подтверждении соответствия впервые выпускаемой в обращение продукции правил и методов исследований (испытаний) и измерений решение органа государственного контроля (надзора) должно быть обосновано. Отказ органа государственного контроля (надзора) может быть обжалован в судебном порядке.
|
|
|
Полномочия органов государственного контроля (надзора).
1. На основании положений настоящего Федерального закона и требований технических регламентов органы государственного контроля (надзора) вправе:
требовать от изготовителя (продавца, лица, выполняющего функции иностранного изготовителя) предъявления декларации о соответствии или сертификата соответствия, подтверждающих соответствие продукции требованиям технических регламентов, или их копий, если применение таких документов предусмотрено соответствующим техническим регламентом;
осуществлять мероприятия по государственному контролю (надзору) за соблюдением требований технических регламентов в порядке, установленном законодательством Российской Федерации;
выдавать предписания об устранении нарушений требований технических регламентов в срок, установленный с учетом характера нарушения;
направлять информацию о необходимости приостановления или прекращения действия сертификата соответствия в выдавший его орган по сертификации; выдавать предписание о приостановлении или прекращении действия декларации о соответствии лицу, принявшему декларацию, и информировать об этом федеральный орган исполнительной власти, организующий формирование и ведение единого реестра деклараций о соответствии;
привлекать изготовителя (исполнителя, продавца, лицо, выполняющее функции иностранного изготовителя) к ответственности, предусмотренной законодательством Российской Федерации;
требовать от изготовителя (лица, выполняющего функции иностранного изготовителя) предъявления доказательственных материалов, использованных при осуществлении обязательного подтверждения соответствия продукции требованиям технического регламента;
|
|
|
принимать иные предусмотренные законодательством Российской Федерации меры в целях недопущения причинения вреда.
2. Органы государственного контроля (надзора) обязаны:
проводить в ходе мероприятий по государственному контролю (надзору) за соблюдением требований технических регламентов разъяснительную работу по применению законодательства Российской Федерации о техническом регулировании, информировать о существующих технических регламентах;
соблюдать коммерческую тайну и иную охраняемую законом тайну;
соблюдать порядок осуществления мероприятий по государственному контролю (надзору) за соблюдением требований технических регламентов и оформления результатов таких мероприятий, установленный законодательством Российской Федерации;
принимать на основании результатов мероприятий по государственному контролю (надзору) за соблюдением требований технических регламентов меры по устранению последствий нарушений требований технических регламентов;
направлять информацию о несоответствии продукции требованиям технических регламентов в соответствии с положениями главы 7 настоящего Федерального закона;
осуществлять другие предусмотренные законодательством Российской Федерации полномочия.
Ответственность органов государственного контроля (надзора) и их должностных лиц при осуществлении государственного контроля (надзора) за соблюдением требований технических регламентов.
1. Органы государственного контроля (надзора) и их должностные лица в случае ненадлежащего исполнения своих служебных обязанностей при проведении мероприятий по государственному контролю (надзору) за соблюдением требований технических регламентов и в случае совершения противоправных действий (бездействия) несут ответственность в соответствии с законодательством Российской Федерации.
2. О мерах, принятых в отношении виновных в нарушении законодательства Российской Федерации должностных лиц органов государственного контроля (надзора), органы государственного контроля (надзора) в течение месяца обязаны сообщить юридическому лицу и (или) индивидуальному предпринимателю, права и законные интересы которых нарушены.
Задача 1.
Массовая доля элемента в соединении рассчитывается по формуле
 =
=  ω(х.э.)
ω(х.э.)
Запишем формулу оксида титана в виде TixOy, тогда, зная из условия, что отношение масс титана и кислорода составляет 2: 1, получим следующее уравнение:

Предположим, что х=1, тогда, решая уравнение, получим у=1,5.
Если х=2, то получим у=3.
х и у должны быть целыми числами, то есть подходит последний вариант – тогда исходный оксид - Ti2O3.
Ответ: оксид титана (III)
Задача 2.
Объемная доля газа рассчитывается по формуле
φ= 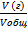 , значит V(газа)=10·0,78=7,8 л
, значит V(газа)=10·0,78=7,8 л
Количество вещества газа находят по формуле
n= 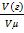 (газа), следовательно, n(газа)=7,8:22,4=0,35 моль
(газа), следовательно, n(газа)=7,8:22,4=0,35 моль
«Безжизненным» газом называли азот.
Задача3.
Химическими процессами являются:
Горение свечи, т.к. выделяется тепло, образуются новые в-ва – сажа и вода.
Скисание молока, т.к. появляется запах и осадок.
Выпечка блинов, т.к. происходит изменение цвета.
Образование накипи, т.к. образуется осадок.
Таяние парафина не является химическим процессом.
Задача 4.
Химический элемент №114 находится в главной подгруппе IV группы, в VII периоде. Конфигурация внешнего энергетического уровня 7s27p2. Он является аналогом свинца, поэтому по химическим свойствам должен быть похож на него. Он должен быть типичным металлом, более химически активным, чем свинец. В своих соединениях он должен проявлять степени окисления +2 и +4. Его оксиды и гидроксиды должны проявлять основные свойства, давая два ряда солей.
Задача 5.
Массу одной молекулы кофеина находим по формуле
m(C6H12O2N4)= 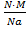 , где NА- число Авогадро
, где NА- число Авогадро
m(C6H12O2N4)=1·172:6,02·1023=28,57·10-23(г)
Задача 1.
Массовая доля элемента в соединении рассчитывается по формуле
 =
=  ω(х.э.)
ω(х.э.)
Запишем формулу оксида железа в виде FexOy, тогда, зная из условия, что отношение масс железа и кислорода составляет 7: 3, получим следующее уравнение:
 =
= 
Предположим, что y=1, тогда, решая уравнение, получим х=0,7.
Если у=2, то х=1,3.
Если у=3, то х=2.
х и у должны быть целыми числами, то есть подходит последний вариант – тогда исходный оксид- Fe2O3.
Ответ: оксид железа (III).
Задача 2.
Объемная доля газа рассчитывается по формуле
φ= 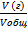 , значит V(газа)=10·0,21=2,1 л
, значит V(газа)=10·0,21=2,1 л
Количество вещества газа находят по формуле
n= 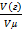 (газа), следовательно, n(газа)=2,1:22,4=0,09 моль
(газа), следовательно, n(газа)=2,1:22,4=0,09 моль
«Флогистоном» Пристли называл кислород.
Задача 3.
Химическими процессами являются:
Горение спиртовки, т.к. выделяется тепло.
Гашение соды, т.к. выделяется газ.
Выпечка пирога, т.к. происходит изменение цвета.
Вздутие консервов, т.к. выделяется газ, и появляется запах.
Закипание воды химическим процессом не является.
Задача 4.
Химический элемент №116 должен находиться в главной подгруппе VI группы, в VII периоде. Конфигурация внешнего электронного слоя 7s27p4. Он является аналогом полония, поэтому по химическим свойствам должен быть похож на него. В химическом отношении он должен проявлять свойства как металла, так и неметалла. В своих соединениях он должен проявлять степени окисления +4 и +6. Его оксиды и гидроксиды должны проявлять кислотные свойства (возможно амфотерные).
Задача 5.
Массу одной молекулы витамина Р находим по формуле
m(C36H28O15)=  , где Na- число Авогадро
, где Na- число Авогадро
m(C36H28O15)=1·700:6,02·1023=116,3·10-23(г)
Задача 1
Анализ брутто-формул позволил определить строение веществ А-Г:
А – H8O3N2С- (NH4)2CO3 – карбонат аммония, средняя соль.
Б – H2O2Cl Fe – Fe(OH)2Cl – хлорид дигидроксожелеза(III), основная соль.
В – H2O6S2 Ba – Ba(HSO3)2 - гидросульфит бария, кислая соль.
Г – O12 S3 Al2- Al2(SO4)3 - сульфат алюминия, средняя соль.
Уравнения характерных реакций:
А: (NH4)2CO3 = NH3 ↑ + H2O + CO2 ↑ (нагрев.) или
(NH4)2CO3 + 2NaOH = NH3 ↑+ H2O + Na2CO3 (нагрев.).
Б: Fe(OH)2Cl + 2HCl = FeCl3 + 2H2O (об.усл.)
В: Ba(HSO3)2 + Ba(OH)2 = 2BaSO3 ↑ + 2H2O (об.усл.) или
Ba(HSO3)2 = BaSO3 + SO2 ↑ + H2O (нагрев.)
Г: Al2(SO4)3 + 6NaOH = Al(OH)3 ↑ + 3Na2SO4 (об.усл.) или
Al2(SO4)3 + 3BaCl2 = 3BaSO4 ↑ + 2AlCl3 (об.усл.).
Задача 2
Уравнения протекающих реакций:
Fe + S = FeS
FeS + 2HCl = FeCl2 + H2S ↑
H2S + Pb(NO3)2 = PbS↓ + Н NO3
Из этих уравнений можно составить стехиометрическую схему:
S → PbS
32 239
из 32 г серы получается 239 г сульфида свинца
из 4,8 г серы ««х г ««
отсюда масса сульфида свинца теоретическая равна:
(4,8·239):32 = 35,85 (г).
Практический выход осадка: 21,15: 35,85 = 0,590 или 59,0%.
Задача 3
М (Na2СO3) = 106 (г/моль)
М (Na2СO3 ·10H2O) = 286 (г/моль)
Находим соотношение между массой «свободной» воды и массой кристаллогидрата в 100 г 10%-ного раствора:
Пересчитаем массу Na2СO3 на массу кристаллогидрата Na2СO3 ·10H2O.
106 г Na2СO3 содержатся в 286 г Na2СO3 ·10H2O
10 г Na2СO3 содержатся в х г Na2СO3 ·10H2O
Масса Na2СO3 ·10H2O равна: (10: 106)· 286 = 26,98 (г).
Масса «свободной воды» равна 100 – 26,98 = 73,02 (г).
Зная это соотношение, находим необходимую массу кристаллогидрата:
В 73,02 г воды растворится 26,98 г Na2СO3 ·10H2O
В 250 г воды растворится х г Na2СO3 ·10H2O
Масса Na2СO3 ·10H2O равна: (250 · 26,98): 73,02 = 92,37 (г)
Задача 4
Pb2+ + Me = Pb + Me2+ (1)
А 207
Cu2+ + Me = Cu + Me2+ (2)
А 64
Увеличение массы пластинки может происходить тогда, когда атомная масса исходного металла будет меньше атомной массы вытесняемого металла (в данном свинца), а уменьшение массы пластинки тогда, когда атомная масса исходного металла больше атомной массы вытесняемого металла.
Таким образом, по реакции (1) увеличение массы составляет (207 – А), а по реакции (2) уменьшение массы составляет (А – 64), где А – атомная масса неизвестного металла.
Масса выделившегося свинца: 207n
Масса выделившейся меди: 64n
Увеличение массы пластинки: 207n - Аn
Уменьшение массы пластинки: Аn - 64n (n - число молей)
Пусть масса пластинки – m, тогда:
m составляет 100%
(207n - Аn) составляет 9,5%
m = (207n - Аn) · 100%: 9,5%
m составляет 100%
(Аn - 64n) составляет 4,8%
m = (Аn - 64n) · 100%: 4,8%
По условию задачи
(207n - Аn) · 100%: 9,5% = (Аn - 64n) · 100%: 4,8%
А = 112, металл кадмий – Сd
Задача 5.
Белый нерастворимый в кислой среде осадок, выпадающий при добавлении Ba(NO3)2, является сульфатом BaSO4. Следовательно, купоросы – соли серной кислоты.
При нагревании до 300°С может удаляться кристаллизационная вода. Следовательно, купоросы – это кристаллогидраты сульфатов двухвалентных металлов.
Представим формулу Х в виде MSO4 · n H2O.
Прокаливание 3,000 г Х привело к потере 3,000 · 0,374 = 1,122 г воды, что соответствует 1,122:18,02 = 0,06226 моль Н2О.
В осадок выпало 2,904:233,40 = 0,01244 моль BaSO4.
Очевидно, что число молей купороса такое же. Следовательно, на моль купороса приходится 0,06226: 0,01244 = 5 моль Н2О, то есть n = 5.
Молярная масса купороса Х равна 3,000: 0,01244 = 241,15 г/моль.
Молярную массу купороса Х можно представить в виде М(Х) = М(М) + M(SO4) + n M(H2O), где М(М) – молярная масса металла М. Отсюда М(М) = 241,15 – 96,06 − 5 · 18,02 = 54,99. Это – марганец.
Таким образом, формула искомого купороса купороса – MnSO4 · 5H2O.
Уравнения реакций:
MnSO4 · 5H2O = MnSO4 + 5H2O↑
MnSO4 + Ba(NO3)2 = Mn(NO3)2 + BaSO4↓.
Задача 1
Анализ брутто-формл позволил определить строение веществ А-Г:
А – H2O5С Cu2 - (CuОH)2CO3 – карбонат гидроксомеди, основная соль.
Б – O2Cl2Ca – Ca(ClО)2 – гипохлорит кальция, средняя соль.
В – H8O7N2Cr2 - (NH4)2Cr2O7 –- дихромат аммония, средняя соль.
Г – H4O8P2Mg - Mg(H2PO4)2 - дигидроортофосфат магния, кислая соль.
Уравнения характерных реакций:
А: (CuOH)2CO3 = 2 CuO + H2O ↑ + СО2 ↑ (нагрев.) или
(CuOH)2CO3 + 4HCl = 2CuCl2 + 3H2O + СО2 ↑ (об.усл.)
Б: Ca(ClО)2 + 4HCl = CaCl2 + 2Cl2↑ + 2H2O (об.усл.) или
Ca(ClО)2 + СО2 + H2O = CaCO3↓ + 2НOCl
В: ( NH4)2Cr2O7 + 4NaOH = 2Na2CrO4 + 2NH3 ↑ + 3H2O (об.усл.) или
( NH4)2Cr2O7 = N2 ↑ + Cr2O3 + 4H2O ↑ (нагрев.)
Г: 3Mg (H2PO4)2 + 12NaOH = Mg3(PO4)2↓ + 4Na3PO4 + 12H2O (об.усл.)
Задача 2
Уравнения протекающих реакций:
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
2H3PO4 + 3Ba(OH)2 = Ba3(PO4)2↓ + 6H2O
Из этих уравнений можно составить стехиометрическую схему:
2P→Ba3(PO4)2
из 62 г фосфора получается 601 г фосфата бария
из 7,5 г фосфора получается х г фосфата бария
отсюда теоретическая масса фосфата бария равна:
(7,5·601): 62 = 72,7(г).
Практический выход осадка: 61,7: 72,7= 0,849 или 84,9%.
Задача 3
М (Na2SO4) = 142 (г/моль)
М (Na2SO4·10H2O) = 322 (г/моль)
Находим соотношение между массой «свободной» воды и массой кристаллогидрата в 100 г 5%-ного раствора:
Пересчитаем массу Na2SO4 на массу кристаллогидрата Na2SO4·10H2O.
В 322 г Na2SO4·10H2O содержатся 142 г Na2SO4
В 57,4 г Na2SO4·10H2O содержатся х г Na2SO4
Масса Na2SO4 равна: (57,4: 322)·142 = 25,31(г).
Находим массу 5%-ного раствора, в которой должен содержаться безводный Na2SO4:
25,31: 0,05 = 506,26 (г).
Из этой массы раствора вычитаем массу исходного кристаллогидрата и получаем необходимую массу воды:
506,26 – 57,4 = 448,86 (г).
Масса воды необходимая для получения раствора равна 448,86 (г).
Задача 4
Pb2+ + Me = Pb + Me2+ (1)
А 207
Cо2+ + Me = Cо + Me2+ (2)
А 59
Увеличение массы пластинки может происходить тогда, когда атомная масса исходного металла будет меньше атомной массы вытесняемого металла (в данном свинца), а уменьшение массы пластинки тогда, когда атомная масса исходного металла больше атомной массы вытесняемого металла.
Таким образом, по реакции (1) увеличение массы составляет (207 – А), а по реакции (2) уменьшение массы составляет (А – 59), где А – атомная масса неизвестного металла.
Масса выделившегося свинца: 207n
Масса выделившегося кобальта: 59n
Увеличение массы пластинки: 207n - Аn
Уменьшение массы пластинки: Аn - 59n (n - число молей)
Пусть масса пластинки – m, тогда:
m составляет 100%
(207n - Аn) составляет 1,42%
m = (207n - Аn) · 100%: 1,42%
m составляет 100%
(Аn - 59n) составляет 0,06%
m = (Аn - 59n) · 100%: 0,06%
По условию задачи
(207n - Аn) · 100%: 1,42% = (Аn - 59n) · 100%: 0,06%
А = 65, металл цинк – Zn
Задача 5.
Белый нерастворимый в кислой среде осадок, выпадающий при добавлении BaCl2, является сульфатом BaSO4. Следовательно, купоросы – соли серной кислоты.
При нагревании до 300°С может удаляться кристаллизационная вода. Следовательно, купоросы – это кристаллогидраты сульфатов двухвалентных металлов.
Представим формулу Х в виде MSO4 · n H2O.
Прокаливание 2,000 г Х привело к потере 2,000 · 0,449 = 0,898 г воды, что соответствует 0,898:18,02 = 0,0498 моль Н2О.
В осадок выпало 1,662:233,40 = 0,00712 моль BaSO4.
Очевидно, что число молей купороса такое же. Следовательно, на моль купороса приходится 0,0498: 0,0712 = 7 моль Н2О, то есть n = 7.
Молярная масса купороса Х равна 2,000: 0,00712 = 280,90 г/моль.
Молярную массу купороса Х можно представить в виде М(Х) = М(М) + M(SO4) + n M(H2O), где М(М) – молярная масса металла М. Отсюда М(М) = 280,90 – 96,06 − 7 · 18,02 = 58,70. Это – никель.
Таким образом, формула искомого купороса купороса – NiSO4 · 7H2O.
Уравнения реакций:
NiSO4 · 7H2O = NiSO4 + 7H2O↑
NiSO4 + BaCl2 = NiCl2 + BaSO4↓.
Задача 1.
KNO3 + H2SO4 = HNO3 + KHSO4
BaSO3 = BaO + SO2
AlCl3 + 3H2O = Al(OH)3 + 3HCl (возможно также написание основных хлоридов алюминия)
СО2 (тв.) = СО2 (газ)
Задача 2.
Один из возможных вариантов:
Источник иода – водоросли. В золе после сгорания водорослей содержатся иодиды калия и натрия. Иод может быть получен электролизом водной суспензии золы с инертными электродами.
Гидроксид натрия легко получить электролизом водного раствора каменной соли.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 266; Нарушение авторских прав?; Мы поможем в написании вашей работы!