
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение. 1)При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; CH4 + O2 = CO2 + 2H2O (слева 2V
|
|
|
|
1) При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
CH4 + O2 = CO2 + 2H2O (слева 2V, справа 3V, равновесие вправо)
C2H6 + 3O2 = 2CO2 + 3H2O (слева 4V, справа 5V, равновесие вправо)
2) Количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы)
Рассмотрим реакцию сгорания метана:
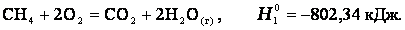
Эту же реакцию можно провести через стадию образования СО:
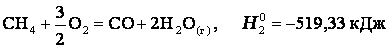
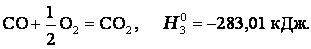
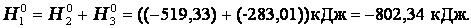
3)
H2+ Cl2 = 2HCl
ΔHреак=ΔH3-ΔH2-ΔH1 = (-431 кДж/моль)–((-436 кДж/моль)+(-243 кДж/моль))=+248 кДж/моль
4) 2CO + O2=2 CO2
ΔНгор= ΣΔНобр прод. – ΣΔНобр реаг
Продукт реакции СО2
Реагент СО и О2
ΔНгор. = 2·ΔНобр(СO2) – [2·ΔНобр(СO) + ΔНобр(O2)]
ΔНгор= 2*(-393)- (2*(-110) + 0)= -566 кДж/моль
5) С(тв) + СО2(г)= 2СО
при плавлении твердого вещества энтропия возрастает
6) Критерием самопроизвольного протекания процессов является увеличение энтропии системы. Процесс может протекать самопроизвольно,даже без поглощения энергии,если при этом увеличивается энтропия.
В основе протекания процессов лежит принцип минимума энергии,т.е система всегда стремится перейти из сост. с большей энергией в сост с меньшей энергией.
7) [ SrCL2+ nH2O ] = [ Sr2++2Cl- + H+ + OH- ]
начальная конечная
[ SrCL2+ nH2O ] = [ SrCL2* 4H2O+ nH2O ] = [ Sr2++2Cl- + H+ + OH- ]
Нач (-43,2) промежут (+65) конеч
ΔН = ΔН1 + ΔН2 = 65 + (-43,2) =21,8 кДж/моль
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 401; Нарушение авторских прав?; Мы поможем в написании вашей работы!