
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродный потенциал
|
|
|
|
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимия изучает окислительно-восстановительные процессы, которые идут под воздействием постоянного электрического тока либо сами являются его источником. Для проведения электрохимического процесса необходима электро-литическая ячейка, электролит, электроды и либо источник, либо потребитель постоянного тока.
Известно, что в узлах кристаллической решетки металла расположены ион-атомы, находящиеся в равновесии со свободными электронами, движущимися по молекулярным орбиталям: Меn+×n 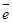 ⇄ Меn+ + n
⇄ Меn+ + n 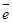 . При контакте металличес-кой пластины (электрода) с раствором электролита полярные молекулы воды, ориентируясь относительно поверхностных узлов кристаллической решетки электрода, отрывают катионы металла и в гидратированном виде переносят их в раствор. Валентные электроны этого катиона остаются в металле, заряжая пластину отрицательно, а раствор электролита при этом заряжается положительно. По мере перехода ионов металла в электролит увеличивается как отрицательный заряд электрода, так и положительный заряд электролита, при этом со временем возникает и обратный переход их на металл. В итоге устанав-ливается равновесие
. При контакте металличес-кой пластины (электрода) с раствором электролита полярные молекулы воды, ориентируясь относительно поверхностных узлов кристаллической решетки электрода, отрывают катионы металла и в гидратированном виде переносят их в раствор. Валентные электроны этого катиона остаются в металле, заряжая пластину отрицательно, а раствор электролита при этом заряжается положительно. По мере перехода ионов металла в электролит увеличивается как отрицательный заряд электрода, так и положительный заряд электролита, при этом со временем возникает и обратный переход их на металл. В итоге устанав-ливается равновесие
Меn+×n 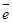 + mH2O ⇄ Ме(H2O)mn+ + n
+ mH2O ⇄ Ме(H2O)mn+ + n 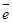
Состояние равновесия зависит как от активности металла, так и от концен-трации его ионов в растворе. На границе раздела металл/раствор возникает двойной электрический слой (ЭДС) (рис.1).
Выделяют два случая (для активных и малоактивных металлов):
1. активные металлы при погружении в растворы своих солей, даже незначительных концентраций, легко посылают ионы в раствор:
Znо – 2ē ® Zn2+ электрод/р-р электролита
Электроны остаются на пластинке и заряжают ее отрицательно «–», ионы же цинка, перешедшие в раствор соли, заряжают жидкость вокруг пластинки положительно «+». На границе раздела металлической пластинки (электрода) с раствором электролита, таким образом, возникает двойной электрический слой толщиной около 10–7 см. Его можно рассматривать как плоский конденсатор.
2 малоактивные металлы, наоборот: их катионы легче переходят на пластинку металла, при этом наблюдается восстановление металла
Сu2+ + 2ē → Cuо.

|

|
Р и с. 1. Двойной электрический слой
В результате этого медная пластинка заряжается положительно, а раствор соли вокруг пластинки из-за избытка анионов заряжается отрицательно. И в этом случае тоже образуется двойной электрический слой с определенной разностью потенциалов.
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом φ. Абсолютное значение электродного по-тенциала определить невозможно, однако можно определить разность элек-тродных потенциалов исследуемого металла и электрода сравнения. Самым распространенным электродом сравнения является водородный электрод, значение электродного потенциала которого в стандартных условиях принято равным нулю. Водородный электрод устроен следующим образом (рис. 2).
Платиновая пластинка помещается в 1M раствор серной кислоты. Снизу в раствор подается водород, который насыщает платину. При этом на ее поверхнос-
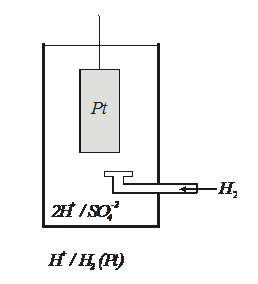
Р и с. 2. Схема водородного электрода
ности устанавливается равновесие
Н2 ⇄ 2Н и Н ⇄ Н+ + 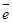 .
.
Ввиду химической пассивности платины в данных условиях возникший электродный потенциал относится к водороду и обозначается φ 02Н+/Н2 = 0,0В.
Для определения значения потенциала металла собирают гальванический элемент из водородного электрода и испытуемого металла, погруженного в 1М раствор его соли. Разница электродных потенциалов двойного электрического слоя или, что то же самое, электродных потенциалов испытуемого металла и водородного электрода при температуре 25°С, атмосферном давлении, концент-рации ионов металла 1 моль-ион/л (стандартные условия) принимается за элек-тродный потенциал испытуемого металла. Например, для цинкового электро-да: φоZn2+/Znо = -0,76В (табл.5). Электродный потенциал является мерой хими-ческой активности металла, т.е. паспортной характеристикой. Выстроенные в по-рядке возрастания стандартных значений φо металлы образуют «ряд напряже-ний», который часто называют рядом активности металлов. Этот ряд обладает следующими свойствами.
1. Чем меньше электродный потенциал металла, тем активнее металл и больше его восстановительная способность.
2. Металлы, имеющие отрицательный электродный потенциал и стоящие в ряду напряжений до водорода, вытесняют его из разбавленных растворов кислот, кроме азотной кислоты.
3. Каждый металл способен вытеснять (восстанавливать) из растворов солей
Таблица 5
Стандартные электродные потенциалы φ 0 некоторых металлов (ряд напряжений)
| Электрод | φ 0, В | Электрод | φ 0, В |
| Li+/Li | -3,045 | Cr3+/Cr | -0,74 |
| Rb+/Rb | -2,925 | Fe2+/Fe | -0,44 |
| K+/K | -2,924 | Cd2+/Cd | -0,403 |
| Cs+/Cs | -2,923 | Co2+/Co | -0,277 |
| Ba2+/Ba | -2,90 | Ni2+/Ni | -0,25 |
| Ca2+/Ca | -2,87 | Sn2+/Sn | -0,136 |
| Na+/Na | -2,714 | Pb2+/Pb | -0,126 |
| Mg2+/Mg | -2,37 | Fe3+/Fe | -0,037 |
| Al3+/Al | -1,70 | 2H+/H2 | -0,000 |
| Ti3+/Ti | -1,603 | Sb3+/Sb | +0,20 |
| Zr4+/Zr | -1,58 | Bi3+/Bi | +0,215 |
| Mn2+/Mn | -1,18 | Cu2+/Cu | +0,34 |
| V2+/V | -1,18 | Cu+/Cu | +0,52 |
| Cr2+/Cr | -0,913 | Hg22+/2Hg | +0,79 |
| Zn2+/Zn | -0,763 | Ag+/Ag | +0,80 |
| Cr3+/Cr | -0,74 | Hg2+/Hg | +0,85 |
| Fe2+/Fe | -0,44 | Pt2+/Pt | +1,19 |
| Cr3+/Cr | -0,74 | Au+3/Au | +1,50 |
| Fe2+/Fe | -0,44 | Au+/Au | +1,70 |
те металлы, которые в ряду напряжений стоят после него. Например, железо вытесняет медь из раствора хлорида меди:
Fe + CuCl2 = FeCl2 + Cu,
а медь вытесняет ртуть из раствора ее соли, например, нитрата ртути:
Cu + Hg(NO3)2 = Hg + Cu(NO3)2.
Для условий, отличных от стандартных по концентрации раствора, величина электродного потенциала рассчитывается по формуле Нернста:
φ = φ 0 + 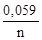 lgCм,
lgCм,
где φ 0 – стандартный потенциал, В; n – число электронов, принимающих участие в процессе; Cм – концентрация ионов металла в растворе, моль/л.
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!