
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развитие творческого мышления в процессе
|
|
|
|
15.2.10.
15.2.6.
15.2.5.
15.2.3.
15.1.11.
15.1.10.
15.1.9.
15.1.8.
15.1.6.
Или
15.1.4.
15.1.3.
15.1.2.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют исчезающе малые размеры. Соударения молекул идеального газа со стенками является абсолютно упругим.
1) 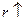
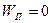
2) 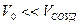
3) Абсолютно упругий удар.
Уравнение состояния идеального газа (Менделеева-Клайперона).
 , (где
, (где 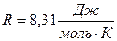 ).
).
Адиабатическим называется термодинамический процесс, в котором система не обменивается теплотой с внешней средой. (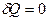 ). Это равенство говорит о том, что в целом за весь процесс алгебраическая сумма теплот, подведенных к системе и отведенных от нее, равна нулю. Практически адиабатический процесс осуществляется при достаточно быстром расширении или сжатии газа.
). Это равенство говорит о том, что в целом за весь процесс алгебраическая сумма теплот, подведенных к системе и отведенных от нее, равна нулю. Практически адиабатический процесс осуществляется при достаточно быстром расширении или сжатии газа.
Уравнение Пуассона для адиабатного процесса:
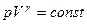 ,
,

Для адиабатного перехода из первого состояния во второе справедливо уравнение Пуассона:
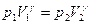
Выражение для коэффициента Пуассона через молярные теплоёмкости при постоянном объёме и постоянном давлении:
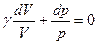 , где
, где 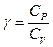

(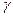 -коэффициент Пуассона).
-коэффициент Пуассона).
15.1.5. Теоретически коэффициент Пуассона определяется по формуле 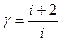 .
.
Значит, подставляя соответствующие значения 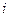 для одно-, двух- и многоатомных газов получаем:
для одно-, двух- и многоатомных газов получаем:
Для одноатомных газов: 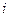 =3.
=3. 
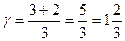
Для двухатомных газов:  =5.
=5. 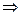
Для многоатомных газов - 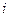 =6.
=6. 
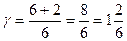
Степень свободы (молекулы идеального газа) - число  , равное числу координат, необходимых для определения местоположения молекулы в пространстве.
, равное числу координат, необходимых для определения местоположения молекулы в пространстве.
Для одноатомной молекулы-  =3.
=3.
Для двухатомной молекулы  =3+2=5.
=3+2=5.
Для многоатомной молекулы- 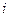 =3+3=6.
=3+3=6.
15.1.7.
Внутренняя энергия - энергия  , зависящая только от внутреннего состояния системы. Внутренняя энергия системы включает в себя энергию всевозможных видов движения и взаимодействия всех частиц (молекул, атомов, ионов и т.д), образующих рассматриваемую систему.
, зависящая только от внутреннего состояния системы. Внутренняя энергия системы включает в себя энергию всевозможных видов движения и взаимодействия всех частиц (молекул, атомов, ионов и т.д), образующих рассматриваемую систему.
Если в результате какого-либо процесса система возвращается в исходное состояние, то полное изменение внутренней энергии равно нулю.
Полная энергия системы включает:
1) Кинетическую энергию 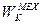 механического движения системы как целого или ее макроскопических частей.
механического движения системы как целого или ее макроскопических частей.
2) Потенциальную энергию 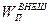 системы во внешнем поле (гравитационном или электромагнитном)
системы во внешнем поле (гравитационном или электромагнитном)
3) Внутреннюю энергию  , зависящую только от внутреннего состояния системы.
, зависящую только от внутреннего состояния системы.
(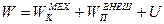 ).
).

Количество теплоты - мера изменения внутренней энергии в процессе теплообмена (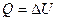 ).
).
Также количество теплоты - энегрия, передаваемая системе внешними телами путем теплообмена.
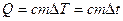 (так как
(так как  ).
).
Теплота плавления- 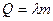 . (
. ( -удельная теплота плавления)
-удельная теплота плавления)
Теплота кипения- 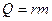 (
( -удельная теплота парообразования).
-удельная теплота парообразования).
Количество теплоты, выделяемое при полном сгорании топлива:  (
(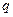 -теплотворность топлива или удельная теплота сгорания топлива).
-теплотворность топлива или удельная теплота сгорания топлива).
В идеальном газе пренебрегают силами межмолекулярного взаимодействия на расстоянии. Соответственно внутреннюю энергию идеального газа можно считать равной сумме кинетических энергий беспорядочного движения всех молекул.
Внутренняя энергия идеального газа представляет собой только кинетическую энергию теплового движения молекул и непосредственно не зависит от объема, занимаемого данной массой газа. При расширении или сжатии идеального газа его внутренняя энергия будет изменяться только за счет происходящего при этом изменения температуры.
Внутренняя энергия идеального газа зависит только от его массы, химического состава и температуры.
I начало термодинамики: теплота, сообщаемая системе, расходуется на изменение внутренней энергии и на совершение системой работы против внешних сил:
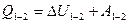

1) Изотермический процесс: (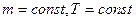 ).
). 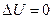
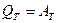
2) Изобарический процесс: (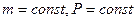 ).
).

3) Изохорический процесс: (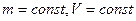 ).
). 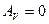
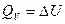
4) Адиабатический процесс: (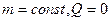 )
) 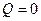

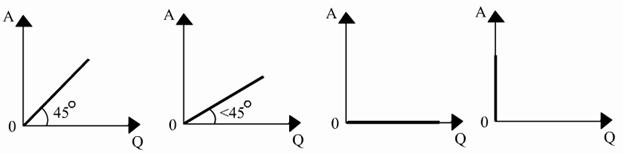
1) 2) 3) 4)
Обратимый процесс- такой процесс, совершаемый термодинамической системой, если после него можно возвратить систему и все взаимодействовавшие с ней тела в их начальные состояния таким образом, чтобы в других телах не возникло никаких остаточных изменений.
В термодинамике доказывается, что необходимое условие обратимости термодинамического процесса- его равновесность.
Пример обратимого процесса- незатухающие колебания пружинного маятника в вакууме.
15.2.1.
Уравнение Пуассона в координатах  :
:
 =const
=const
Уравнение Пуассона в координатах 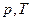 :
:
 =const
=const
15.2.2.
Молярные теплоемкости  и
и  для идеального газа легко найти из уравнения
для идеального газа легко найти из уравнения 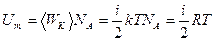 , если учесть, что
, если учесть, что 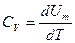 , а
, а 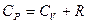 . Таким образом,
. Таким образом,  ,
,  . Из этого следует, что молярные теплоемкости идеального газа зависят от числа степеней свободы его молекул. (А
. Из этого следует, что молярные теплоемкости идеального газа зависят от числа степеней свободы его молекул. (А 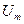 -внутренняя энергия, линейно зависит от термодинамической температуры Т газа и от числа степеней свободы его молекул)
-внутренняя энергия, линейно зависит от термодинамической температуры Т газа и от числа степеней свободы его молекул)
 =
= 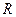 . (уравнение Майера) Физический смысл уравнения Майера заключается в том, что при изобарном нагревании газа к нему должна быть подведена б о льшая теплота, чем для такого же изохорного нагревания. Разность теплот должна быть равна работе, совершенной газом при изобарном расширении.
. (уравнение Майера) Физический смысл уравнения Майера заключается в том, что при изобарном нагревании газа к нему должна быть подведена б о льшая теплота, чем для такого же изохорного нагревания. Разность теплот должна быть равна работе, совершенной газом при изобарном расширении.
Поэтому теплоемкость газа при постоянном объеме меньше теплоемкости при постоянном давлении. (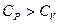 ).
).
15.2.4. Как удельная теплоёмкость связана с молярной теплоёмкостью?
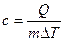 ,
, 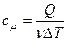 .
.
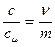 .
.
Изотермический процесс расширения или сжатия газа может происходить в условиях, когда теплообмен между газом и внешней средой осуществляется при постоянной разности температур. Для этого теплоемкость внешней среды должна быть достаточно велика и процесс расширения (или сжатия) должен происходить весьма медленно. Изотермическими являются процессы кипения, конденсации, плавления и кристаллизации химически чистых веществ, происходящие при постоянном внешнем давлении.
Адиабатный процесс- термодинамический процесс, в котором система не обменивается теплотой с окружающей средой. Из этого определения следует, что в адиабатном процессе 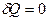 . Следует отметить, что условие отсутствия теплообмена нельзя формулировать в виде
. Следует отметить, что условие отсутствия теплообмена нельзя формулировать в виде 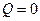 . Это равенство говорит лишь о том, что в целом за весь процесс алгебраическая сумма теплот, подведенных к системе и отведенных от нее, равна нулю. Условие
. Это равенство говорит лишь о том, что в целом за весь процесс алгебраическая сумма теплот, подведенных к системе и отведенных от нее, равна нулю. Условие 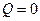 вовсе не исключает теплообмена между системой и внешней средой на отдельных участках рассматриваемого процесса. Практически адиабатный процесс осуществляется при достаточно быстром расширении или сжатии газа.
вовсе не исключает теплообмена между системой и внешней средой на отдельных участках рассматриваемого процесса. Практически адиабатный процесс осуществляется при достаточно быстром расширении или сжатии газа.
1) Адиабатический процесс идеального газа:

2) Изотермический процесс идеального газа:
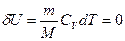
3) Изобарический процесс идеального газа:

4) Изохорический процесс идеального газа:
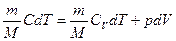
15.2.8. Для адиабатного процесса идеального газа:
 .
.
Если идеальный газ адиабатно расширяется, то 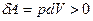 и
и 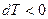 , то есть происходит охлаждение газа.
, то есть происходит охлаждение газа.
Если идеальный газ адиабатно сжимается, то 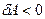 и
и 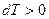 , то есть происходит нагревание газа.
, то есть происходит нагревание газа.
15.2.9. Из первого закона термодинамики  имеем для адиабатного процесса
имеем для адиабатного процесса 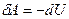 , то есть в адиабатном процессе система совершает работу за счет убыли внутренней энергии системы.
, то есть в адиабатном процессе система совершает работу за счет убыли внутренней энергии системы.
Выведение расчетной формулы для коэффициента Пуассона:
Для адиабатного перехода газа из первого состояния во второе справедливо уравнение Пуассона:
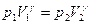 (1)
(1)
Сравнивая конечное третье состояние газа с первым состоянием, мы видим, что точки 1 и 3 лежат на одной изотерме. Поэтому, применяя закон Бойля-Мариотта, имеем
 , причем
, причем 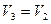 (2)
(2)
Из уравнений (1) и (2) можно определить 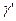 . Для этого возводим уравнение (2) в степень
. Для этого возводим уравнение (2) в степень 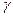 и делим его на уравнение (1):
и делим его на уравнение (1):
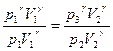 или
или 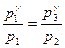 ,
,
откуда
 .
.
Логарифмируя последнее выражение, находим исходный коэффициент:
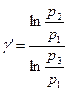 . (3)
. (3)
Обозначим разность уровней жидкости в манометре в первом состоянии через  и в третьем состоянии через
и в третьем состоянии через 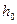 . В таком случае имеем:
. В таком случае имеем:
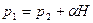
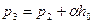 . (4)
. (4)
(где 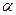 -переводной коэффициент для перехода от разности уровней к давлению).
-переводной коэффициент для перехода от разности уровней к давлению).
Из (4) получаем
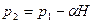
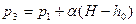
и подставляем в (3)
 .
.
Величина  и
и  много меньше единицы. Для малых значений
много меньше единицы. Для малых значений 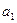 и
и  справедливо приближенное выражение
справедливо приближенное выражение  . Применяя его получим:
. Применяя его получим:
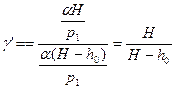 .
.
15.2.11. Цель данной работы- экспериментальное определение безразмерной величины, называемой показателем адиабаты или коэффициентом Пуассона для воздуха методом адиабатного расширения.
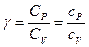 .
.
Кроме того  .
.
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 257; Нарушение авторских прав?; Мы поможем в написании вашей работы!