
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение. Лабораторная работа № 9. Определение отношения теплоемкостей идеального газа методом Клемана - Дезорма
|
|
|
|
Лабораторная работа № 9. Определение отношения теплоемкостей идеального газа методом Клемана - Дезорма
Цель работы: Определение коэффициента Пуассона методом адиабатического сжатия.
Идеальным газом называется система молекул, которые находятся в непрерывном хаотическом движении и между ними отсутствуют силы межмолекулярного взаимодействия. Вдали от области фазовых превращений реальные газы можно считать идеальными.
Число параметров, определяющих положение и ориентацию молекул газа в пространстве, будем называть числом ее степеней свободы - 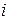 .
.
Согласно положению о равнораспределении энергии по степеням свободы, на каждую степень свободы молекулы приходится энергия равная:  , поэтому средняя энергии молекулы газа, должна равняться:
, поэтому средняя энергии молекулы газа, должна равняться:
 [1]
[1]
где 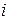 - сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы,
- сумма поступательных, вращательных и удвоенного числа колебательных степеней свободы,  - постоянная Больцмана.
- постоянная Больцмана.
Для молекул с жесткими межатомными связями (нет колебательных степеней свободы) имеем:
1. Одноатомная молекула - 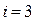 (три поступательные степени свободы).
(три поступательные степени свободы).
2. Двухатомная молекула -  (три поступательные и две вращательные степени свободы).
(три поступательные и две вращательные степени свободы).
3. Трехатомная молекула -  (три поступательные и три вращательные степени свободы).
(три поступательные и три вращательные степени свободы).
Внутренняя энергия одного моля идеального газа, содержащего  молекул, равна:
молекул, равна:
 [2]
[2]
где 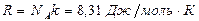 - универсальная газовая постоянная. Для
- универсальная газовая постоянная. Для  (где
(где  - общее число молекул) молей газа имеем:
- общее число молекул) молей газа имеем:
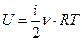 [3]
[3]
Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона) связывает  - давление, объем и абсолютную температуру газа:
- давление, объем и абсолютную температуру газа:
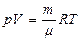 [4]
[4]
где 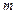 - масса газа,
- масса газа,  – молярная масса газа (масса одного моля).
– молярная масса газа (масса одного моля).
Теплоёмкостью тела называется величина, численно равная количеству теплоты 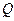 , которую необходимо ему сообщить, чтобы изменить температуру
, которую необходимо ему сообщить, чтобы изменить температуру 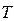 на один градус Кельвина:
на один градус Кельвина:
 [5]
[5]
где  - изменение температуры тела,
- изменение температуры тела,  – количество теплоты, сообщённое телу.
– количество теплоты, сообщённое телу.
Поделив [5] на массу газа 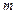 и на молярную массу
и на молярную массу  , получим, соответственно удельную и молярную теплоемкости:
, получим, соответственно удельную и молярную теплоемкости:
 ;
;  [6]
[6]
Для определения теплоёмкости идеального газа воспользуемся первым началом термодинамики, согласно которому количество теплоты -  , переданное системе затрачивается на изменение её внутренней энергии
, переданное системе затрачивается на изменение её внутренней энергии 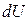 и совершение системой работы
и совершение системой работы  против внешних сил:
против внешних сил:
 [7]
[7]
Из выражения [7], следует, что величина теплоемкости зависит от способа нагревания:
Изохорный процесс: 
При изохорном процессе изменение объема 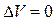 , в этом случае с учётом равенств [7] и [3] получим величину теплоёмкости при постоянном объеме:
, в этом случае с учётом равенств [7] и [3] получим величину теплоёмкости при постоянном объеме:
 или
или  [8]
[8]
Изотермический процесс: 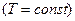
В этом случае изменение температуры 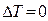 , и первое начало термодинамики имеет вид:
, и первое начало термодинамики имеет вид:

Так как, температура не меняется, теплоемкость  . Изотермический процесс описывается уравнением Бойля-Мариотта:
. Изотермический процесс описывается уравнением Бойля-Мариотта:
 [9]
[9]
Изобарный процесс: 
При изобарном процессе:
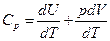 [10]
[10]
После дифференцирования уравнения Менделеева-Клайперона [4] при постоянном давлении получим:
 [11]
[11]
Выражение [11] позволяет выяснить физический смысл универсальной газовой постоянной: она численно равна работе совершаемой одним молем идеального газа 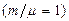 при повышении его температуры на 1 К, при изобарном процессе.
при повышении его температуры на 1 К, при изобарном процессе.
Подставив [11] в [10] и, учитывая [8] найдем теплоемкость при изобарном процессе:
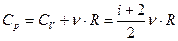 [12]
[12]
Разделив [12] на число молей  , получим уравнение Майера, связывающее молярные теплоёмкости идеального газа (теплоёмкости одного моля вещества):
, получим уравнение Майера, связывающее молярные теплоёмкости идеального газа (теплоёмкости одного моля вещества):
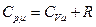 [13]
[13]
Поделив [12] на [8], найдем отношение теплоемкостей 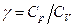 (коэффициент Пуассона) для идеального газа:
(коэффициент Пуассона) для идеального газа:
 [14]
[14]
Используя [14], находим теоретические значения  для идеальных газов:
для идеальных газов:
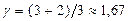 для одноатомного
для одноатомного  ,
,
 для двухатомного
для двухатомного 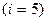 ,
,
 для трехатомного идеального газа
для трехатомного идеального газа 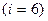 .
.
Для экспериментального определения этого отношения Клеман и Дезорм предложили метод адиабатического сжатия.
Адиабатическим называется процесс, протекающий без теплообмена с окружающей средой  , для такого процесса первое начало термодинамики, с учетом [8] имеет вид:
, для такого процесса первое начало термодинамики, с учетом [8] имеет вид:
 [15]
[15]
отсюда следует, что при адиабатическом изменении объема газ совершает работу за счёт изменения своей внутренней энергии. Поэтому при таком процессе температура газа изменяется: при сжатии повышается, а при расширении уменьшается.
Решая совместно [15] и [4] можно получить уравнение Пуассона для адиабатического процесса:
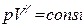 [16]
[16]
Для определения  по методу Клемана-Дезорма нужно осуществить замкнутый процесс (цикл), диаграмма которого приведена на рис. 1.
по методу Клемана-Дезорма нужно осуществить замкнутый процесс (цикл), диаграмма которого приведена на рис. 1.
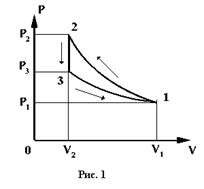 Уравнение Пуассона для адиабатического сжатия кривая (1-2):
Уравнение Пуассона для адиабатического сжатия кривая (1-2):
 [17]
[17]
при этом температура и давление газа увеличиваются до 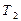 и
и 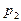 , соответственно. Если при постоянном объеме
, соответственно. Если при постоянном объеме  температуру уменьшить до первоначального значения
температуру уменьшить до первоначального значения  , то давление уменьшится от
, то давление уменьшится от 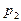 до
до 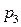 , (отрезок 2-3). При последующем изотермическом процессе 3-1, который описывается выражением [9], газ возвращается в исходное состояние.
, (отрезок 2-3). При последующем изотермическом процессе 3-1, который описывается выражением [9], газ возвращается в исходное состояние.
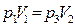 [18]
[18]
возведем равенство [18] в степень  и разделим его на равенство[17]. После сокращения на
и разделим его на равенство[17]. После сокращения на  получим:
получим:
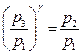 или
или 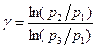 [19]
[19]
Описание установки и расчетные формулы
Для осуществления метода Клемана-Дезорма используется прибор (рис. 2) состоящий из большого стеклянного баллона Б, соединенного с насосом Н и водяным манометром М. на пробке баллона имеется клапан К, при открытии которого баллон сообщается с атмосферным воздухом. Клапан открывается рычагом. Если при открытом клапане К медленно откачать из баллона воздух, то температура в нем изменится, а давление будет меньше атмосферного  на величину
на величину  , т.е.
, т.е.
 [20]
[20]
 это состояние соответствует точке 1 (рис. 1). Величина
это состояние соответствует точке 1 (рис. 1). Величина  измеряется манометром М, по разности уровней жидкости в манометре h. Для осуществления адиабатического процесса 1-2 нужно на короткое время открыть клапан К, при этом давление воздуха в баллоне сравняется с атмосферным.
измеряется манометром М, по разности уровней жидкости в манометре h. Для осуществления адиабатического процесса 1-2 нужно на короткое время открыть клапан К, при этом давление воздуха в баллоне сравняется с атмосферным.
Если после откачивания в баллоне объемом 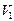 остается масса воздуха m, то при открывании клапана в баллон войдёт дополнительная порция воздуха, а масса m займет меньший объем
остается масса воздуха m, то при открывании клапана в баллон войдёт дополнительная порция воздуха, а масса m займет меньший объем  при давлении
при давлении 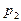 . Т.к. процесс кратковременный и заметного теплообмена газа в баллоне с окружающей средой нет, то процесс можно считать близким к адиабатному. После адиабатического сжатия (кривая 1-2) температура воздуха в баллоне повышается до
. Т.к. процесс кратковременный и заметного теплообмена газа в баллоне с окружающей средой нет, то процесс можно считать близким к адиабатному. После адиабатического сжатия (кривая 1-2) температура воздуха в баллоне повышается до 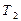 (точка 2).
(точка 2).
В результате теплообмена температура газа в баллоне через 2-3 мин. практически станет равной комнатной, а давление будет меньше атмосферного (точка 3):
 [21]
[21]
процесс теплообмена (2-3) происходит при постоянном объеме. Конечное состояние этого процесса соответствует точке 3. т.к. точки 1 и 3 соответствуют одинаковой температуре, то они должны лежать на одной изотерме, для которой выполняется выражение[18].
Т.к. давление измеряется жидкостным манометром, то 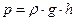 и формулы [20] и [21] можно заменить на значения давления в мм водяного столба:
и формулы [20] и [21] можно заменить на значения давления в мм водяного столба:
 и
и 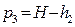 [22]
[22]
Для определения  через
через  и
и  подставим последние выражения в [19] и разложим
подставим последние выражения в [19] и разложим 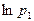 и
и 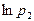 в ряд Тейлора и, ограничиваясь первыми двумя членами разложения, получим
в ряд Тейлора и, ограничиваясь первыми двумя членами разложения, получим  :
:
 [23]
[23]
значения  , найденные по формуле [23], сильно зависят от времени, на которое открывается клапан 3. это связанно с тем, что чем меньше время, тем меньшее количество теплоты отдает газ, через стенки сосуда и тем ближе процесс к адиабатическому, а измеренное значение
, найденные по формуле [23], сильно зависят от времени, на которое открывается клапан 3. это связанно с тем, что чем меньше время, тем меньшее количество теплоты отдает газ, через стенки сосуда и тем ближе процесс к адиабатическому, а измеренное значение  ближе к истинному.
ближе к истинному.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 1798; Нарушение авторских прав?; Мы поможем в написании вашей работы!