
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Введение. По сопротивлению материалов
|
|
|
|
Минск 2011
ФИО
Принял
ФИО
По сопротивлению материалов
Расчетно-проектировочные работы
БЕЛОРУССКИЙ национальный
Требования к выполнению и оформлению расчётно-проектировочных работ
технический университет
Кафедра «Сопротивления материалов
и теория упругости»
Выполнил студент
группа …
Задача 1 «Расчет ступенчатого стержня»
Условие
С о д е р ж а н и е
у с л о в и я
Расчетная схема
Ч е р т е ж
р а с ч е т н о й
с х е м ы
Задача 2 «Расчет стержневой системы»
Условие
С о д е р ж а н и е
у с л о в и я
Расчетная схема
Ч е р т е ж
р а с ч е т н о й
с х е м ы
Примечание:
Каждую задачу следует начинать с новой страницы.
Решение
Решение задачи следует вести в числовом виде, вычисления достаточно вести с точностью до двух значащих цифр после запятой. Расчеты следует проводить последовательно, аккуратно в соответствии с требованиями задания. Если одна из расчетных величин определяется по готовой формуле, то недостаточно привести эту формулу и конечный результат, следует показать как получен этот результат. При построении эпюр следует располагать их на одном листе с расчетной схемой.
Указание для студентов заочников. При выборе номера схемы задачи следует руководствоваться следующим правилом: личный номер (шифр) студента от 1 до 30 соответствует номеру схемы. Если личный номер больше 30, то номер схемы определяется путем деления личного номера на число 30. Целое число частного не используется, а остаток определяет номер схемы.
Например:
личный номер студента 289; тогда 289/30=9 и 19 в остатке-
номер схемы 19.
Работы, выполненные с нарушением этого правила,
не рецензируются.
При защите расчетно-проектировочной работы студент должен отвечать на вопросы, связанные с ее выполнением, уметь решить контрольную задачу по ее тематике.
При подготовке специалистов-биологов среди общих биологических дисциплин важное место занимает цитология – наука о строении и функциях клетки. Цитология – наука экспериментальная, поэтому в учебном плане подготовки биологов, кроме лекционного времени, по данной дисциплине отводится время на лабораторные занятия.
В задачи лабораторного практикума по цитологии с основами гистологии входят: проверка и закрепление теоретических положений, излагаемых в лекционных курсах и учебниках; ознакомление со строением клеток и тканей животных и растений; знакомство и работа с современными световыми микроскопами; получение навыков научно-исследовательской работы, способности описывать и обобщать полученный материал; приобретение навыков приготовления препаратов как временных, так и постоянных, формирование общенаучных, инструментальных и общепрофессиональных компетенций.
Лабораторные занятия выполняются индивидуально. Лаборатории должны быть оснащены современными световыми микроскопами: люминесцентный AxioImager.D1, проходящего и отраженного света AxioImager D1; микроскопы Axiostar plus производство ZEIZZ; санными микротомами НМ 430; спектрофотометрами Analytik jena SPEKOL 1300 для ознакомления с разнообразными клетками, тканями, процессами деления клеток, интерактивными техническими средствами обучения, компьютерной техникой для проверки знаний тестированием UniTest версии 3.0.0.
К лабораторному практикуму студент допускается только после инструктажа по технике безопасности. Основные положения техники безопасности изложены в инструкциях, которые должны находиться на видном месте в лаборатории.
Правила работы с микроскопом
Микроскоп необходимо содержать в чистоте и предохранять от повреждений. В нерабочем состоянии микроскоп должен быть накрыт чехлом. Особое внимание следует обращать на чистоту объективов и других оптических деталей.
ВНИМАНИЕ! Нельзя касаться пальцами поверхностей линз. Для предохранения оптических деталей визуальной насадки от пыли следует оставлять окуляры в тубусах или надевать на них колпачки.
Оптические поверхности окуляров, объективов и конденсора можно осторожно протирать чистой ватой, навернутой на деревянную палочку и смоченной специальной жидкостью для чистки оптических деталей. При загрязнении внутренних поверхностей линз объектива необходимо объектив отправить для чистки в оптическую мастерскую.
ВНИМАНИЕ! Запрещается самим разбирать объективы, окуляры, конденсор.
Рассмотрим важнейшие погрешности при работе с микроскопом, чтобы начинающие исследователи не допускали их с самых первых шагов, добиваясь таким образом максимального использования возможностей микроскопа. К таким ошибочным действиям необходимо отнести следующие действия:
одновременное применение вогнутого зеркала и конденсора, что нарушает принцип освещения препарата;
использование высокоапертурных конденсоров с NA = 1,2 – 1,4 с низкоапертурными объективами с NA = 0,2 – 0,4, ухудшающих качество изображения. Для устранения этой ошибки следует предварительно уменьшить нумерическую апертуру конденсора путем снятия (отвинчивания) его верхней линзы;
произвольное опускание конденсора без учета толщины предметного стекла может привести к появлению артефактов;
регулировка освещенности поля зрения микроскопа при помощи опускания и поднятия конденсора поскольку это влияет на качество изображения;
произвольное изменение величины отверстия апертурной диафрагмы конденсора с целью регулировки освещенности поля зрения микроскопа;
пренебрежение нейтральными светофильтрами и матовыми стеклами для регулировки освещенности поля зрения микроскопа, что ухудшает восприятие препарата и может оказывать отрицательное влияние на зрение исследователя;
применение толстых предметных стекол (толще 1, 2 мм), что препятствует правильной установке освещения при высокоапертурных объективах, поскольку при этом не удается сфокусировать конденсор на объекте;
 применение покровных стекол несоответствующей толщины (толще или тоньше 0,17 мм);
применение покровных стекол несоответствующей толщины (толще или тоньше 0,17 мм);
пренебрежение созданием полной иммерсии при работе с объективами, имеющими нумерическую апертуру более 1,2, что не позволяет полностью использовать нумерическую апертуру объектива.
Меры безопасности при работе с микроскопом
При работе с микроскопом с осветителем следует соблюдать меры безопасности, соответствующие мерам, принимаемым при эксплуатации электроустановок напряжением до 1000 В.
ВНИМАНИЕ! Замену лампы в осветителе микроскопа производить только при отключении от электрической сети. Во избежание ожога кожи рук о колбу лампы или контактные пластины патрона замену лампы следует производить через 15 – 20 мин после ее перегорания.
Замену плавкой вставки (предохранителя) в микроскопе следует производить при отключенном от сети микроскопе.
После работы на микроскопе с осветителем необходимо отключить его от сети.
Не рекомендуется оставлять без присмотра включенный в сеть микроскоп.
Устройство микроскопа
Микроскоп представляет собой оптический прибор, дающий увеличенное изображение мелких объектов и их деталей. Хотя различные марки световых микроскопов имеют конструктивные отличия, в каждом из них существуют оптические и механические узлы.
Устройство микроскопа наглядно показано на Рис. 1.

Рис. 1. Устройство микроскопа Primo Star: 1 – окуляры; 2 – бинокулярная насадка; 3 – револьверное устройство; 4 – объектив; 5 – предметный столик; 6 – конденсор; 7 – показатель интенсивности освещения; 8 – включение и выключение микроскопа; 9 – рук
оятка грубой фокусировки; 10 – рукоятка тонкой фокусировки; 11- рукоятка перемещения предметного столика
Оптический узел составляют осветительная система (конденсор и зеркало), объективы и окуляры вместе с тубусом, все составные части строго центрированы одна в отношении другой.
Механический узел микроскопа состоит из штатива, на котором крепятся оптические детали, предметного столика и механизмов фокусировки микроскопа.
Настройка освещения микроскопа с вынесенным осветителем
В соответствии с принципом Келера при установке освещения для микроскопа типа МБИ-3, а также микроскопов серии Микмед с вынесенным осветителем необходимо руководствоваться следующими правилами:
1. Устанавливают осветитель ОИ-19 (или ОИ-9м) перед микроскопом с помощью соединительной планки, что обеспечивает нормальное расстояние микроскопа от осветителя. Включают его через трансформатор в сеть и, поворачивая корпус, направляют световой поток на плоскоезеркало микроскопа.
2. Поднимают конденсор микроскопа в верхнее положение и полностью закрывают его диафрагму.
3. Уменьшают диаметр отверстия ирисовой диафрагмы осветителя до 1 – 2 мм.
4. Перемещая патрон лампочки осветителя вдоль оси и одновременно поворачивая зеркало микроскопа и корпус осветителя, добиваются получения изображения нити лампочки на закрытой диафрагме конденсора. При этом центр изображения нити лампочки должен находиться в центральной части ирисовой диафрагмы.
5. Открывают отверстие диафрагмы конденсора и осветителя.
6. Уменьшают яркость свечения нити лампочки при помощи реостата.
7. Помещают исследуемый препарат на предметный столик микроскопа, ставят необходимый объектив в рабочее положение и, глядя в окуляры бинокулярной насадки микроскопа, перемещением тубуса фокусируют оптику микроскопа на объект.
8. Почти полностью закрывают диафрагму осветителя и перемещением конденсора добиваются резкого изображения диафрагмы осветителя в поле зрения микроскопа.
9. Поворотом зеркала центрируют изображение диафрагмы осветителя, а затем открывают ее настолько, чтобы изображение диафрагмы было равно (или немного больше) полю зрения микроскопа.
10. Вынимают один окуляр и, глядя в тубус микроскопа, уменьшают диафрагму конденсора до едва заметного появления ее краев на фоне светлого кружка задней линзы объектива.
11. Помещают окуляр на место. В прорези осветителя вставляют синее и матовое стекла. Затем, глядя в микроскоп, при помощи реостата осветителя устанавливают необходимую освещенность препарата.
12. Исследуют препарат.
Примечания.
1. При работе с низкоапертурными объективами малого увеличения (10х и меньше) перед настройкой освещения устанавливают сменный низкоапертурный конденсор или, если это позволяет конструкция конденсора, отделяют (отвинчивают) его верхнюю линзу.
2. Пункт 7 можно выполнить в самом начале при произвольно установленном освещении, а затем внести коррективы в соответствии с принципом Келера.
Настройка освещения микроскопа с встроенным в основание осветителем
Порядок настройки микроскопа со встроенным осветителем:
1. Устанавливают матовое стекло в откидную рамку конденсора.
2. Вводят в ход лучей объектив меньшего увеличения (10х и менее).
3. Вводят в ход лучей матовое стекло и откидную линзу конденсора.
4. Поднимают рукояткой кронштейн с конденсором до упора и полностью раскрывают апертурную диафрагму конденсора.
5. Устанавливают патрон с лампой в шарнир до упора.
6. Устанавливают лампу таким образом, чтобы ее нить располагалась горизонтально.
7. Подключают источник питания к сети и включают лампу.
8. Фокусируют микроскоп на резкое изображение препарата, установленного на предметном столике.
9. Перемещая патрон с лампой за рукоятку вдоль оси и разворачивая его вместе с шарниром в горизонтальной плоскости, добиваются наиболее яркого и равномерного освещения поля зрения микроскопа.
10. При работе с другим объективом повторяют настройку освещения.
11.ВНИМАНИЕ! При работе с объективами с увеличением более 10х откидная линза конденсора должна быть выведена из хода лучей.
Приготовление постоянных и временных препаратов
Постоянные препараты являются прекрасным демонстрационным материалом и могут храниться долгие годы. На тонких срезах толщиной 10-22 микрона можно наблюдать проникновение пыльцевых трубок, подсчитывать число хромосом, изучать митоз и мейоз, развитие зародыша и так далее.
Техника приготовления окрашенных микропрепаратов включает в себя несколько этапов. Объекты претерпевают сложную обработку.
1. Подготовка материала к фиксации.
2. Фиксирование материала водным или спиртовым фиксатором (24 часа и до 12 часов соответственно).
3. Промывка зафиксированного материала.
4. Полное обезвоживание промытого материала.
5. Пропитывание материала растворителями парафина (хлороформом, ксилолом или бензолом).
6. Пропитывание материала парафином до полного испарения хлороформа (или ксилола).
7. Заливка материала в парафин (материал, залитый в парафин, можно хранить очень долго).
8. Изготовление блоков из материала, пропитанного парафином.
9.Получение срезов при помощи микротома.
10. Наклейка срезов на предметные стекла.
11. Просушивание препаратов при температуре 40 – 45о С, стекла со срезами можно хранить долго, оберегая их от пыли и высокой температуры.
12. Удаление парафина из срезов ксилолом.
13. Удаление ксилола из срезов спиртом.
14. Удаление спирта из срезов дистиллированной водой.
15. Окрашивание препаратов (иногда протравливание и окрашивание) и дифференцировка.
16. Обезвоживание окрашенных срезов 96%-ным и 100%-ным спиртами.
17. Замещение спирта в срезах на ксилол (одновременно происходит просветление срезов ксилолом).
18. Заключение срезов в канадский бальзам.
19. Просушивание и подчистка, этикетирование препаратов.
20. Изучение препаратов под микроскопом.
Также широко распространены в микроскопической технике давленые препараты, для изготовления которых не требуется сложной процедуры обезвоживания, заключения в промежуточную жидкость, в парафин и получения микротомных срезов. Давленые препараты применяют при изучении митоза, кариотипов и при работе с животными объектами.
Наиболее часто для приготовления давленых препаратов применяют различные фиксаторы. Зафиксированный материал промывают в 70 %-ном спирте. В нем можно сохранять материал в течение длительного времени, но лучше хранить в холодильнике. При изготовлении давленых препаратов исключительное значение имеют способы мацерации тканей. Обычно для этого используют 45 %-ную уксусную кислоту, 40 – 45 %-ную пропионовую кислоту, 1 н. соляную кислоту, энзимы.
Окрашивают препараты ацетокармином, реактивом Шиффа, нигрозином и другими красителями.
Важнейшие характеристики микроскопа
Микроскоп для цитологических исследований должен иметь набор из 4 – 7 высокоапертурных объективов-апохроматов, в том числе объективов 90х с нумерической (числовой) апертурой (A)1,3 – 1,4; набор компенсационных окуляров; апланатический конденсор прямого и косого освещения с Aне менее 1,4; штатив; механизмы фокусировки объективов и перемещения препаратов; бинокулярную насадку для наблюдения в микроскоп обоими глазами; набор светофильтров, а также точную центрировку всех оптических и механических деталей микроскопа. Кроме того, микроскоп должен быть оснащен осветителем, который может быть как вынесенным (ОИ-9м для МБР-3), так и встроенным (у микроскопов МБИ-6; МБИ-11; Микмед-1, вариант 2). Освещение устанавливают в соответствии с принципом Кёлера, который заключается в обеспечении условий для максимального использования апертур оптических компонентов микроскопа, т. е. в создании условий наблюдения, при которых числовые апертуры конденсора и объектива совпадают.
Конденсор состоит из двух или трех линз и обеспечивает освещение полей на объекте при работе с объективами с увеличением от 3,5 до 100х. Различают несколько типов конденсоров в зависимости от метода наблюдения в микроскопе: конденсор светлого поля, конденсор темного поля, конденсор для наблюдений по методу фазового контраста, конденсор с апертурной диафрагмой для косого освещения и др. Например, конденсор ОИ-14 кроме прямого освещения объекта обеспечивает косое, что позволяет получить более рельефное и контрастное изображение.
Зеркало микроскопа имеет две поверхности – плоскую и выгнутую, оно располагается под конденсором и направляет в него свет. Из конденсора пучок света попадает на препарат, находящийся на столике микроскопа, а затем попадает в окуляр.
Визуальная насадка микроскопа (тубус), как правило, бинокулярная.Она позволяет устанавливать расстояние между осями окулярных тубусов в соответствии с глазной базой наблюдателя в диапазоне от 54 до 72 мм (на Рис. 2, возможность изменения этого расстояния показана стрелками). В левом окулярном тубусе имеется диоптрийный механизм, который с помощью вращения кольца 2 позволяет компенсировать ошибку наблюдателя от плюс 5 до минус 5 дптр. Окулярные тубусы имеют наклон 45°. Увеличение бинокулярной насадки — 1,5х.
В комплект микроскопа может входить монокулярнаянасадка, которая позволяет проводить исследование объектов только одним глазом. В отличие от бинокулярной насадки она имеет увеличение, равное 1х. При использовании такой насадки можно применять полярофильтры для исследования в поляризованном свете. При работе с объективами, рассчитанными на длину тубуса, отличающуюся от стандартной, 160 мм, применяется вертикальнаянасадка с прямым выдвижным тубусом. С помощью шкалы на выдвижном тубусе устанавливается механическая длина тубуса, на которую рассчитан объектив.
Окуляры нередко состоят из двух линз. Они могут иметь различное увеличение и позволяют проводить наблюдения в полях зрения разного диаметра (табл. 1).
Таблица 1
Характеристика некоторых окуляров
| Маркировка окуляра | Увеличение | Диаметр поля зрения, мм |
| К5х | ||
| К7х | ||
| К10х | ||
| K10х/18 | ||
| К15х | ||
| К20х |
Окуляры строят мнимое изображение и увеличивают создаваемое объективами изображение, не выявляя подробностей строения. Маркировка окуляра позволяет определить его увеличение, а в некоторых случаях – диаметр поля зрения.
Револьверное устройство обеспечивает установку четырех объективов. Смена объективов производится вращением револьверного устройства за конусную поверхность до фиксированного положения.
Объективы выполняют главную функцию: в их системе линз формируется первичное изображение, которое передается в окуляры. Объективы рассчитаны на механическую длину тубуса 160 мм, линейное поле в плоскости изображения 18 мм и толщину покровного стекла 0,17 мм.
Большое значение имеет полное или частичное отсутствие в объективе оптических аберраций, которые могут привести к тому, что изображение объекта может быть искаженным вследствие его размытости, искривления, окрашенности.
Аберрации оптики микроскопа могут быть разного типа. Сферическая аберрация – изображение точки передается в виде кружка рассеяния. Астигматизм – изображение точки передается в виде кружка рассеяния эллипсоидной формы. Кома – резкость изображения снижается от центра к границе поля зрения. Кривизна поля зрения не позволяет одновременно видеть резко центр и края поля зрения. Дисторсия – нарушения подобия между объектом и его изображением вследствие разного линейного увеличения на краях и в центре поля зрения. Хроматические аберрации – хроматизм увеличения и хроматизм положения. Хроматизм положения – изображения, созданные разными цветами, располагаются на неодинаковом расстоянии от оптической системы. Хроматизм увеличения – изображения находятся в одной плоскости, но имеют неодинаковые размеры. Высококачественные объективы-апохроматы изготавливают с высокой нумерической апертурой. В них устранены сферическая и хроматическая аберрации. Объективы-апохроматы применяются в сочетании с компенсационными окулярами.
Характеристики некоторых объективов указаны в табл. 2.
Каждый объектив характеризуется определенной величиной рабочего расстояния в миллиметрах. При работе с объективами следует соблюдать осторожность, чтобы не повредить линзы. Особенно это важно при работе с объективами с большим увеличением, для которых рабочее расстояние(расстояние между поверхностью покровного стекла и линзой объектива) составляет 0,10 – 0,12 мм.
Фокусирование на объект осуществляют перемещением тубусодержателя. Грубую фокусировку производят вращением рукояток макровинта, расположенных по обеим сторонам тубусодержателя. Диапазон грубой фокусировки микроскопа – 40 мм. Тонкую фокусировку производят с помощью микровинта, выполненного в виде диска с накаткой. Один оборот диска соответствует перемещению тубусодержателя на 0,5 мм, а вращение диска от упора до упора – не менее 2 мм. Перед началом работы необходимо установить рукоятку тонкой фокусировки приблизительно в среднее положение.
Таблица 2
Некоторые характеристики объективов
| Объективы | Увеличение, числовая апертура, наличие иммерсии | Рабочее расстояние, мм |
| Планахроматы | 9 х 0,20 | 13,13 |
| 10 х 0,20 | 13,13 | |
| Ахроматы | 8 х 0,20 | 8,53 |
| 20 x 0,40 | 1,70 | |
| 40 х 0,65 | 0,41 | |
| 85 х 1,00 (ВИ)* | 0,18 | |
| 90 х 1,25 (МИ)** | 0,10 | |
| Апохроматы | 10 х 0,30 | 4,80 |
| 20 х 0,65 | 0,67 | |
| 90 х 1,3 | 0,12 |
Примечание. * Водная иммерсия. ** Масляная иммерсия
Препарат крепят на предметном столике с помощью клемм или держателей. Предметные столики могут быть различной формы, вращаемыми, оснащенными препаратоводителями с координатным перемещением объекта, у которых держатели можно перемещать относительно друг друга (в зависимости от размера предметного стекла) при помощи винтов (Рис. 1).
Осветительные устройства могут быть вынесенными, накладными и встроенными. В случае вынесенного осветителя используется зеркало. Оно имеет две отражающие поверхности: плоскую и вогнутую. Вогнутую поверхность используют при естественном освещении, в отдельных случаях она может служить для повышения освещенности объекта. Накладные осветители ОИ-32М или ОИ-35 вставляют в посадочное гнездо в основании микроскопа. Встроенный в основание микроскопа осветитель включает галогенную лампу, коллекторную линзу, вблизи фокуса которой располагается нить лампы.
Разрешающая способность объектива
Каждый объектив характеризуется определенной разрешающей способностью, фокусным расстоянием (глубиной резкости) и увеличением.
Разрешающая способность объектива микроскопа (d) — наименьший диаметр частицы, которую можно увидеть при данном объективе, или то наименьшее расстояние между двумя линиями, при котором они видны как отдельные. Разрешающая способность объектива микроскопа зависит от значений нумерической (числовой) апертуры (A) объектива и конденсора и длины волны источника света (λ). Для пучка лучей, параллельных оптической оси микроскопа, разрешающую способность объектива микроскопа определяют по формуле
d = λ/A
Для наклонных лучей разрешающая способность в 2 раза выше:
d = λ/2A,
где λ – длина волны, нм; А – числовая апертура объектива.
Длина волны лучей источника света в видимой части спектра может меняться от 0,4 мкм (400 нм) для фиолетовых лучей до 0,7 мкм (700 нм) для красных. Следовательно, чем короче длина волны лучей источника света и чем больше апертура объектива, тем выше разрешающая способность объектива микроскопа, т. е. тем более тонкие структуры мы сможем увидеть в микроскоп. При освещении объекта наклонными лучами разрешающая способность объектива микроскопа в 2 раза выше, чем при освещении прямо падающими лучами. Освещая препарат синими лучами (λ = 0,47 мкм), т. е. применяя в осветителе синий светофильтр, можно изучать более тонкие структуры, чем при освещении обычным белым светом.
Пример: для объектива с A =1,4 при освещении белым светом (λ = 0,55 мкм) диаметр наименьшей видимой частицы при прямо падающем свете равен 0,39 мкм, при косом освещении – 0,20 мкм, а при освещении синим светом – 0,34 и 0,17 мкм, соответственно. Максимальное разрешение, которое можно получить при использовании светового микроскопа, 0,20 – 0,35 мкм. Увеличить разрешающую способность можно при использовании ультрафиолетового света (длина волны 0,26 – 0,28 мкм), что позволяет получить разрешение 0,13 – 0,14 мкм.
Числовая апертура объектива
Числовая, или нумерическая, апертура (А) объектива характеризует светособирательную способность и определяется по формуле
A= n∙sinα,
где n – показатель преломления среды между фронтальной линзой объектива и покровным стеклом; α – половинный угол входного отверстия объектива (угол, одна сторона которого совпадает с оптической осью, другая образована линией, соединяющей точку выхода лучей из объектива с границей действующего отверстия объектива) (Рис. 2).

Рис. 2. Угол отверстия объектива микроскопа: Об – объектив; Кн – конденсор; Р – плоскость препарата; F – фронтальная плоскость; α – угол отверстия объектива
Общее увеличение микроскопа
Увеличение объектива указано на оправе, там же указана и числовая апертура. Конденсоры тоже имеет определенную числовую апертуру. Если апертура конденсора меньше апертуры объектива, то возможности объектива, таким образом, используются в работе неполностью.
Общее увеличение микроскопа определяется как произведение увеличения объектива (V об) на увеличение окуляра(V ок):
V= Vоб · Vок .
Если объектив имеет увеличение 90х, а окуляр 15х, то общее увеличение равно 1350. Увеличения, превышающие эту величину, не имеют значения и их называют бесполезными и это связано с тем, что структуру препарата окуляр может увеличить настолько, чтобы она просматривалась под тем же углом зрения, что и в объективе. Это увеличение называется полезным, и оно равно 1000 А. Расчеты показывают, что полезное увеличение не может превышать 1300 –1450 раз. Большее увеличение не выявляет новых деталей на изображении, а освещенность его становится меньше.
Глубина резкости изображения
Глубина резкости изображения(глубина фокуса) – способность объектива одновременно давать резкие изображения точек, находящихся от него на разном расстоянии, или глубина препарата, видимая одновременно резко. Она зависит от увеличения микроскопа и апертуры объектива. Каждый объектив позволяет видеть препарат на определенную глубину в одной плоскости. На большом увеличении необходимо поочередно фокусировать объектив в разных плоскостях. На малых увеличениях и малой апертуре глубина резкости больше, чем при больших увеличениях. Показатель глубины резкости следует особенно учитывать при микрофотографии, когда необходимо четко видеть изображение объекта в одной плоскости зрения. Её определяют по формуле:
T = (1000/7A∙V)+(λ/2A2), где
А – апертура, V – увеличение микроскопа, λ – длина волны.
При небольших увеличениях и малой апертуре глубина резкости больше, чем при больших увеличениях и высокой апертуре.
Качество микроскопа определяется не увеличением, а разрешающей способностью оптических устройств.
В случае сухих объективов (без использования жидких сред – иммерсии) коэффициент преломления равен единице (п = 1) и A < 0,95.
При иммерсионной системе у объектива микроскопа пространство между фронтальной линзой и рассматриваемым предметом заполнено жидкостью с более высоким показателем преломления, чем воздух. Для иммерсионных объективов нумерическая апертура зависит от показателя преломления жидкости, находящейся между препаратом и объективом. Поэтому для водно-иммерсионных объективов A меньше либо равно 1,25 (вода имеет n = 1,33), а для масляно-иммерсионных объективов A меньше либо равно 1,4 (кедровое масло имеет n = 1,515). На рисунке 3 представлен ход лучей при использовании масляной иммерсии и сухого объектива.
 |
Рис. 3. Сравнение хода лучей при использовании сухого (слева) и иммерсионного масляного (справа) объективов
Как видно из этого рисунка, в сухой системе некоторая часть лучей не попадает в объектив, так как при выходе из покровного стекла, они отклоняются. Лучи, которые в месте выхода к поверхности стекла образуют угол больше 41о (предельный угол), полностью отражаются. Для стекла и воды предельный угол равен 41°, для кедрового масла и стекла он не существует по причине равенства показателей их преломления. Для улучшения качества изображения часто применяется полная иммерсия, когда иммерсионную жидкость наносят и на конденсор.
При работе с иммерсионными объективами следует соблюдать осторожность, чтобы при опускании тубуса не повредить линзу.
Иммерсионную жидкость наносят между линзой и объективом в виде капли на поверхность покровного стекла препарата и, опуская затем тубус, погружают линзу в каплю иммерсии. Иммерсионную жидкость можно нанести и на поверхность линзы объектива либо по капле и на препарат, и на объектив. Главное требование — создание иммерсии без пузырьков воздуха.
Только в случае соответствия апертур коллектора осветителя, конденсора и объектива разрешающая способность оптики микроскопа используется полностью.
Задание. Определить зависимость Т и d от длины волны
Ознакомиться с объективами, окулярами и конденсором биологического микроскопа. Приготовить временный препарат кожицы лука и рассмотреть его при разных длинах волн, используя цветные светофильтры: красный, синий и зеленый. Зарисовать препарат при трех длинах волн. Определить, при какой длине волны видны более мелкие детали. Рассчитать разрешающую способность и глубину резкости. Результаты занести в табл.3.
Таблица 3
Зависимость разрешающей способности и глубины резкости от длины волны света
| Показатель | Увеличение | λ=440 нм | λ=570 нм | λ=680 нм |
| d | 8х | |||
| d | 40х | |||
| T | 8х | |||
| T | 40х |
Сделать вывод о зависимости d и T от длины волны (λ).
Общий план строения растительной и животной клеток
Клетка является элементарной самовоспроизводящейся единицей структуры и функции абсолютно всех живых существ, обнаруживаемых на планете Земля. Среди живых организмов встречается два типа организации клеток. К наиболее простому типу строения можно отнести клетки бактерий и сине-зеленых водорослей, которые принято называть прокариотическими, к более организованному – клетки всех остальных живых существ, начиная от низших растений и кончая человеком, эукариотические. На Рис. 4, 5 показана схема строения клеток про- и эукариот.
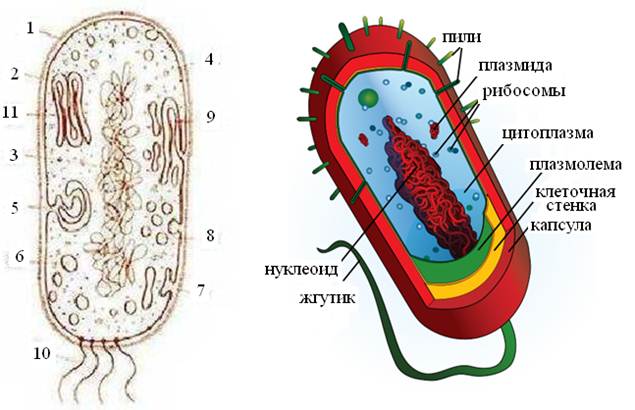
Рис. 4. Комбинированная схема прокариотической клетки: 1 – клеточная стенка; 2 – плазматическая мембрана; 3 – ДНК нуклеоида; 4 – полирибосомы цитоплазмы; 5 – мезосома; 6 – ламеллярные структуры; 7 – впячивания плазмалеммы; 8 – скопления хроматофоров; 9 – вакуоли с включениями; 10 – бактериальные жгутики; 11 – пластинчатые тилакоиды
Прокариотические клетки отличаются от эукариотических более простым (примитивным) строением. Прокариотическая клетка не имеет оформленного ядра – его функции выполняют нуклеоид. В прокариотической клетке отсутствуют центриоли, а также одномембранные и двумембранные органоиды – их функции выполняют мезосомы. Рибосомы, органоиды движения и оболочки прокариотических клеток имеют специфическое строение.
Учитывая уникальную роль растений как источников создания органических веществ, знакомство с эукариотическими клетками целесообразно начать с рассмотрения клетки зеленого растения. При этом основное внимание следует обратить на строение живой клетки, для изучения которой используют световой микроскоп.
В отличие от клеток животных клетки растений имеют плотную, обычно углеводную оболочку, окружающую живую часть клетки (протопласт), пластиды, из которых наибольшее значение имеют хлоропласты, осуществляющие процесс фотосинтеза, и крупные вакуоли, заполненные сильно обводненным клеточным соком. Однако перечисленные признаки не универсальны. Так, некоторые клетки растений, например гаметы и зооспоры водорослей, не имеют оболочки, от внешней среды они отграничены плазматической мембраной, идентичной мембране, окружающей клетку животных организмов. Зеленые пластиды свойственны лишь растениям, использующим для синтеза органических веществ энергию солнечного света. У гетеротрофных организмов, пользующихся готовыми органическими веществами (грибы), их нет.
Вакуоли характерны для взрослых клеток, уже закончивших рост. В клетках образовательных тканей (меристем), находящихся в кончике корня и на верхушке побега, а также в клетках семян, вакуолей обычно нет или они очень мелкие.
Таким образом, специфичность структуры растительной клетки определяется характером ее жизнедеятельности, возрастным состоянием и таксономическими особенностями.
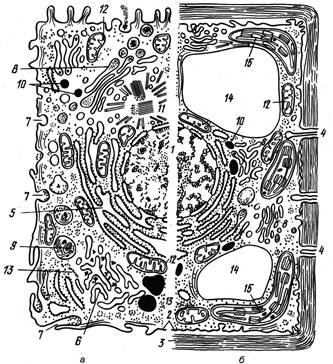
Рис. 5. Комбинированная схема строения эукариотической клетки: а – животного происхождения; б – растительного происхождения: 1 – ядро с хроматином, 2 – плазматическая мембрана, 3 – клеточная оболочка, 4 – плазмодесмы, 5 – гранулярная эндоплазматическая сеть, 6 – агранулярная эндоплазматическая сеть, 7 – образующиеся пиноцитозные вакуоли, 8 – комплекс Гольджи, 9 – лизосома, 10 – жировые включения, 11 – центриоль и микротрубочки, 12 – митохондрии, 13 – полирибосомы, 14 – вакуоли, 15 – хлоропласты
У низших растений клетка нередко представляет собой целый, самостоятельно живущий организм. Примерами таких одноклеточных растений могут быть зеленые водоросли (хлорелла, хламидомонада) и некоторые грибы (дрожжи). Тело многоклеточного растения состоит из многих комплексов клеток, имеющих разные размеры, форму, внутреннее строение и выполняющих разные функции. Клетки, утратившие в процессе развития живое содержимое, могут участвовать в проведении воды, некоторые из них защищают растение от механических воздействий, колебаний температур и так далее.
Поэтому в ботанике термин «клетка» употребляют не только для тех структурных единиц, которые имеют протопласт, дифференцированный на цитоплазму, ядро, пластиды, митохондрии и другие органоиды, но и для оболочек, оставшихся после отмирания протопластов.
Плазматическая мембрана или плазмалемма – поверхностная периферическая структура, ограничивающая клетку снаружи. Играет роль барьера, ограничивает свободный поток низко- и высокомолекулярных веществ в обе стороны через мембрану. Также она выступает как структура, рецептирующая различные химические вещества и регулирующая избирательно транспорт этих веществ в клетку.
Строение клеток развивающихся листьев элодеи канадской (Elodea canadensis Michx.)
Элодея – пресноводное растение с мутовками продолговато-овальных листьев на тонком стебле. Наиболее молодые клетки, структура которых еще не сформирована, составляют мелкие зачатки листьев, расположенные на верхушке побега под конусом нарастания. Для приготовления препарата верхушку побега (не более 1 см длиной) кладут на предметное стекло в большую каплю воды и осторожно под микроскопом или лупой двумя препаровальными иглами удаляют крупные листья. Самые мелкие чешуевидные листья, скученные на верхушке побега, отрывают от стебля, расправляют, накрывают покровным стеклом и рассматривают при малом, а затем при большом увеличении микроскопа. Размеры и форма клеток зависят от размеров развивающейся листовой пластинки. Самые молодые листовые зачатки, которые удается отделить от стебля, состоят из клеток, очертания которых довольно сильно варьируют. Большинство клеток многоугольные, некоторые – узкие, удлиненные. Часто встречаются клетки только что возникшие в результате деления. Оболочки клеток очень тонкие, плотно сомкнутые. Клетки заполнены густой цитоплазмой, окружающей крупное, хорошо заметное ядро. Мелкие тельца, также расположенные в цитоплазме, представляют собой хлоропласты (Рис. 6 а, б).

Рис. 6. Строение клеток листа элодеи: а, б, – последовательные стадии развития клеток; 1 – ядра; 2 – пластиды; 3 – вакуоли
В нижерасположенных листьях по мере увеличения размеров клеток число пластид и их размеры увеличиваются, содержимое клеток становится более светлым, прозрачным вследствие появления вакуолей с водянистым клеточным соком; ядра заметны не во всех клетках. У молодых клеток может быть несколько мелких вакуолей, которые по мере роста и дифференцировки клетки сливаются друг с другом и образуют одну или несколько крупных вакуолей, занимающих до 90 % всего объема клеток. Центральная вакуоль отделена от цитоплазмы одинарной мембраной, сходной по толщине с плазмалеммой. Такая мембрана называется тонопласт. Вакуоли выполняют разнообразные функции. Одной из главных функций является поддержание тургорного давления клеток. Растворенные в соке вакуолей молекулы определяют его осмотическую концентрацию. Также вакуоли могут использоваться клетками в качестве накопительных резервуаров, где не только откладываются запасные вещества, но и собираются метаболиты, предназначенные для экскреции. Чтобы увидеть ядра, листья можно обработать раствором йода в водном растворе йодида калия (убивающего клетку), от этого реактива ядра становятся бурыми.
Задание. Приготовить временный препарат зачатка листа. Рассмотреть и зарисовать молодую и развивающуюся клетку. Сделать подписи к рисункам. Описать различия молодой и развивающейся клетки.
Строение клеток сформированного листа элодеи
Оторванный от стебля лист кладут нижней стороной в каплю воды на предметное стекло, накрывают покровным стеклом и рассматривают при малом и большом увеличении микроскопа. Лист элодеи значительно больше поля зрения микроскопа, поэтому даже при работе с малым увеличением препарат приходится передвигать. Лист состоит из двух слоев клеток, причем клетки верхнего слоя, обращенного к наблюдателю, крупнее клеток нижнего слоя. Уже при малом увеличении обращает на себя внимание неравномерная окраска листовой пластинки, в середине которой вдоль листа располагается «средняя жилка», состоящая из более светлых клеток. Краевые клетки листа почти прозрачные. Некоторые клетки выступают наружу в виде острых зубцов (Рис. 7а) с концами, обращенными к верхушке листа. В клетках основания листовой пластинки зубцов нет (Рис. 7б). Наружные стенки зубцов очень толстые, красновато-бурые.
Параллельно «средней жилке» вдоль листа проходят узкие темные полосы разной длины. Они представляют собой систему межклетников – пространств между клетками верхней и нижней сторон листа, заполненных воздухом. Под микроскопом межклетники выглядят темными из-за большой разницы в показателях преломления света воздуха (n=1) и клеточных оболочек (n=1,5). Когда вода, показатель преломления света которой близок показателю преломления оболочек (n=1,33), войдет в межклетники через поврежденные места и вытеснит из них воздух, межклетники станут незаметными.

Рис. 7. Клетки сформированного листа элодеи:1 – ядро; 2 – хлоропласты; 3 – вакуоль; 4, 8 – цитоплазма; 5 – зубчик листа; 6 – оболочка клетки; 7 – межклетник; 9 – клетки «средней жилки»
Клетки имеют тонкие прозрачные стенки, плотно соединенные между собой. Размеры, форма клеток, а также число содержащихся в них зеленых пластид – хлоропластов варьируют.
Клетки «средней жилки" узкие, сильно вытянутые по длине листа, пластид в них немного, большинство из них располагается вдоль боковых стенок. Очертания этих пластид овальные.
Клетки, прилегающие к «средней жилке», более широкие, квадратные, многоугольные или продолговатые. В клетках много пластид, в плане они округлые, в боковой проекции – овальные или эллиптические. Ядро, цитоплазма и вакуоль в клетке не видны, так как показатели преломления света всех этих структур примерно одинаковы. Ядро становится заметным, если лист обработать раствором йода в водном растворе йодида калия, однако следует помнить, что этот реактив убивает клетку.
О наличии цитоплазмы и об условных границах клеточной вакуоли можно судить лишь по перемещению пластид, происходящему вдоль клеточных стенок по часовой или против часовой стрелки, что характерно для кругового, или ротационного движения. В таких клетках цитоплазма, окружающая крупную центральную вакуоль, занимает постенное положение. В клетках только что оторванного листа цитоплазма обычно не движется или движется очень медленно, но спустя несколько минут движение становится хорошо заметным сначала в клетках средней жилки, а затем и в прилегающих к ней клетках.
Клетки, расположенные по краю листовой пластинки, вытянуты в длину, но значительно короче клеток средней жилки. Их наружные стенки толще внутренних. Клетки бедны содержимым, находящиеся в них немногочисленные пластиды значительно мельче, чем в остальных клетках. При внимательном рассмотрении в краевых клетках, в том числе и в зубцах, можно видеть ядра, представляющие собой светлые мелкозернистые тельца.
Ознакомиться с общим планом строения листа, следует более детально рассмотреть особенности слагающих его клеток при большом увеличении.
Задание. Приготовить временный препарат сформированного листа элодеи. Рассмотреть, зарисовать и описать препарат. Сделать подписи к рисункам.
Клетки кожицы листа валлиснерии (Vallisneria spiralis L.)
Для приготовления препарата на любой из сторон линейного листа валлиснерии скальпелем или препаровальной иглой надрезают кожицу, кусочек которой сдирают с листовой пластинки, кладут в каплю воды на предметное стекло, осторожно накрывают покровным стеклом и рассматривают при малом и большом увеличении микроскопа (Рис. 8).
Клетки кожицы либо вытянуты по длине листа, либо имеют квадратные или многоугольные очертания. Оболочки клеток тонкие, прозрачные, плотно примыкающие одна к другой. В клетках видны многочисленные зеленые тельца – хлоропласты, или хлорофилловые зерна. Хлоропласт имеет форму двояковыпуклой линзы, фронтальная сторона которой всегда обращена к клеточной стенке.

Рис. 8. Кожица листа валлиснерии: 1 – оболочка клетки; 2 – хлоропласты; 3 – ядро; 4 – направления движения цитоплазмы; 5 – цитоплазма
При внимательном наблюдении можно видеть, что пластиды перемещаются вдоль клеточных стенок. Это происходит вследствие движения вокруг центральной вакуоли цитоплазмы. Такое движение называют круговым или ротационным (циклоз).
Движение цитоплазмы играет важную роль в осуществлении обменных процессов и распределении веществ внутри клетки. В естественных условиях цитоплазма движется очень медленно, под влиянием физических или химических раздражителей движение обычно ускоряется. Это движение называют вторичным. Довольно быстрое движение цитоплазмы в клетках валлиснерии вызвано механическим повреждением листа в связи со снятием кожицы. Сначала оно заметно лишь в некоторых, а затем почти во всех клетках. Движение можно ускорить, если лист на несколько минут положить в теплую воду или добавить в нее каплю спирта.
Задание. Приготовить временный препарат кожицы листа валлиснерии. Рассмотреть препарат при малом и большом увеличении. Зарисовать клетку и видимые органеллы. Сделать подписи к рисунку. Описать препарат.
Плазмолиз в клетках кожицы чешуи луковицы репчатого лука (Аlliит сера L.)
Для ознакомления со строением клеток и особенностями плазмолиза можно использовать кожицу, покрывающую внутренние чешуи луковицы лука. Слегка надрезанная скальпелем или препаровальной иглой кожица обычно легко сдирается. Ее рассматривают в воде под покровным стеклом при малом и большом увеличении микроскопа.
Клетки кожицы разных размеров, многоугольные, с тонкими, плотно сомкнутыми стенками (Рис. 9). В некоторых местах стенки пересечены узкими канальцами – порами, которые посередине перегорожены тонкой мембраной. В клетке хорошо видно ядро с ядрышком. Ядро окружено цитоплазмой, составляющей так называемый ядерный кармашек, соединенный тяжами с постенным слоем цитоплазмы. В цитоплазме встречаются капли эфирных масел, а в вакуолях – мелкие кубические или призматические кристаллы щавелевокислого кальция.


Рис. 9. Плазмолизированные клетки чешуи лука: 1 – ядро; 2 – вакуоли; 3 – кристалл оксалата кальция; 4 – оболочка клетки; 5 – плазмалемма; 6 – нити Гехта
Цитоплазма в клетках кожицы лука более вязкая, чем у водных растений. О высокой вязкости цитоплазмы можно судить по характеру плазмолиза. Во многих клетках плазмолиз вогнутый. Отошедшие от стенок искривленные участки протопласта обращены к стенкам вогнутыми сторонами. В некоторых местах протопласт связан с клеточными стенками тонкими цитоплазматическими тяжами – «нитями Гехта», часть которых со временем разрывается.
Лучше всего наблюдать плазмолиз в клетках лиловых чешуй лука. Окраска чешуй обусловлена наличием в клеточном соке водорастворимого пигмента – антоциана. По мере выхода из вакуоли воды концентрация пигмента увеличивается, и окраска клеточного сока становится интенсивнее.
Задание. Приготовить временный препарат чешуи лука. Рассмотреть препарат при малом и большом увеличении. Зарисовать клетки эпидермиса внутренней чешуи луковицы лука: общий вид и плазмализированные клетки. Сделать подписи к рисунку. Описать препарат.
|
|
|
|
|
Дата добавления: 2014-12-24; Просмотров: 2162; Нарушение авторских прав?; Мы поможем в написании вашей работы!