
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Биохимические показатели биологических жидкостей человека 4 страница
|
|
|
|
Рабочее название. В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Классы ферментов. Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
1. Оксидоредуктазы. Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
2. Трансферазы. Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
3. Гидролазы. Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
4. Лиазы. К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
5. Изомеразы. Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
6. Лигазы (синтетазы). Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами, или синтетазами
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одноморганизме, но, как правило, в разных его клетках, тканях или органах. Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
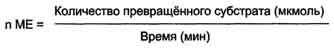
Одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов
.  .
.
Количество единиц активности nME определяют по формуле:
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов В6, РР, В2).
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Кофакторы выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
E-Me-S
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
· производные витаминов;
· гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
· нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
· убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
· фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
· S-аденозилметионин (SAM) - донор метильной группы;
· глутатион, участвующий в окислительно-восстановительных реакциях.
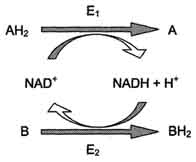
Витамин РР входит в состав кофермента НАД+ и НАДФ+, который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода - пример последовательных реакций, продуктом - восстановленная форма NAD, для фермента Е2 - наоборот.
Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) — кофермент ацетилирования; один из важнейших коферментов; принимает участие в реакциях переноса ацильных групп. Молекула КоА состоит из остатка адениловой кислоты, связанной пирофосфатной группой с остаткомпантотеновой кислоты, соединённой пептидной связью с остатком β-меркаптоэтаноламина.
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид — кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования вмитохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ.
23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибиторы ферментов.
К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Для конкурентного типа ингибирования справедливы следующие уравнения:
Е + S ⇔ ES → E + P,
E + I ⇔ EI.
Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др.
Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
Необратимые ингибиторы ферментов как лекарственные препараты. Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
24.Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Каталитический и регуляторный центры. Четвертичная структура аллостерических ферментов и кооперативные изменения конформации протомеров фермента.
Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостери-ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:
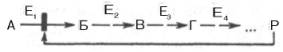
Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное инги-бирующее действие на первую стадию процесса и соответственно на фермент E1.
Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру. Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конфор-мационные изменения, наблюдаемые при присоединении субстрата и эффекторов. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса).
Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости v от [ S ] в присутствии модулятора обусловлен эффектом кооперативности. Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы в активном центре, способствуя тем самым увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрации субстрата.
25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
Химическая модификация фермента. Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации. Оказалось, что активность ряда ключевых ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорили-рования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами. Уровень активности ключевых ферментов обмена углеводов и соответственно интенсивность и направленность самих процессов обмена определяются соотношением фосфорилированных и дефосфорилированных форм этих ферментов. Обычно различают обратимую ковалентную и нековалентную химические модификации ферментов, осуществляемые через ОН-группысерина, реже – тирозина или за счет нековалентных взаимодействий с молекулой фермента. В первом случае активным ферментомоказывается или фосфорилированная, или дефосфорилированная форма, как в случае с молекулами мышечной фосфорилазы и гликогенсинтазы соответственно). В качестве примеров можно в виде схемы представить оба типа модификации, в которой символом Р обозначается остаток фосфата, Pi– неорганический фосфат (Н3РО4), РРi – неорганический пирофосфат (Н4Р2О7),АМФ – остаток адениловой кислоты. Химическая постсинтетическая модификация ферментов включает, кроме того, процессы ограниченного протеолиза,метилирования, гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др., обеспечивая тем самым микроскопический тип регуляции активности ферментов и соответственно физиологическую скорость процессов обмена веществ.
Общим фундаментальным механизмом, посредством которого реализуются биологические эффекты «вторичных» мессенджеров внутри клетки, является процесс фосфорилирования – дефосфорилирования белков при участии широкого разнообразия протеинкиназ, катализирующих транспорт концевой группы от АТФ на ОН-группы серина и треонина, а в ряде случаев – тирозина белков-мишеней. Процесс фосфорилирования представляет собой важнейшую посттрансляционную химическую модификацию белковых молекул, коренным образом изменяющую как их структуру, так и функции. В частности, он вызывает изменение структурных свойств (ассоциацию или диссоциацию составляющих субъединиц), активирование или ингибирование их каталитических свойств, в конечном итоге определяя скорость химических реакций и в целом функциональную активность клеток.
26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
Сравнение множества клеток самых разных типов показывает, что набор содержащихся в них ферментов во многом сходен. По-видимому, во всех живых организмах протекают в основном одни и те же метаболические процессы; некоторые различия, касающиеся конечных продуктов обмена, отражают скорее наличие или отсутствие того или иного фермента, нежели изменение общего характера метаболизма. Сложные системы углеводного обмена, состоящие из ферментов, коферментов и переносчиков, образуют главный поставляющий энергию механизм у животных, растений, плесневых грибов, дрожжей и у большинства других микроорганизмов. Однако в характере метаболизма, химическом составе и строении различных тканей и различных организмов имеются и бесспорные различия. Что касается метаболизма, то особенности его в соответствующих органах или тканях, несомненно, определяются набором ферментов. Различия в химическом составе органов и тканей тоже зависят от их ферментного состава, в первую очередь от тех ферментов, которые участвуют в процессах биосинтеза. Не исключено, что и более очевидные различия, касающиеся строения и формы тех или иных органов и тканей, также имеют энзимологическую природу: Известно, что строение и форма находятся под контролем генов; контроль осуществляется путем образования специфических белков, из которых главными для организации тканей являются ферменты я транспортные системы. Продуктами генов могут быть также белки, не обладающие каталитическими свойствами, но играющие важную роль в «встраивании» ферментных белков в соответствующие структурные ансамбли, например мембраны; однако такие молекулы можно рассматривать как компоненты катализаторов, поскольку они находятся в теснейшей взаимосвязи с ними.
27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать
по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
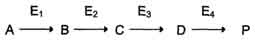
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей:
Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:

· Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов
Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:
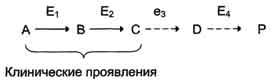
· Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
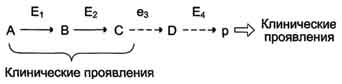
· Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы. Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличиваетсяактивность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. озрастание активности ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося ихбиосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих вкровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществсвязано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.
28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определении глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты
Второе направление медицинской энзимологии – энзимодиагностика – развивается по двум путям. Один путь – использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых). Другой путь – открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»). Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов(и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоформ) и лактатдегидрогеназы (и ее изоформ) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того,активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэсте-разы и некоторых других органоспецифических ферментов (например, гистидазы, уроканиназы, глицинамидинотрансферазы) в сыворотке крови при патологии костной ткани, печени, метастатических карциномах и т. д. Доказано, что органы и ткани человека характеризуются специфическим ферментным и изоферментным спектром, подверженным не только индивидуальным, но и суточным колебаниям. Существует большой градиент концентрации ферментов между внутриклеточными и внеклеточными частями тела. Поэтому любые, даже незначительные, повреждения клеток (иногда функциональные расстройства) приводят к выделению ферментов во внеклеточное пространство, откуда они поступают в кровь. Механизм гиперферментации (повышенное содержание ферментов в крови) до конца не расшифрован. Повышение уровня внутриклеточных ферментов в плазме крови прямо зависит от природы повреждающего воздействия, времени действия и степени повреждения биомембран клеток и субклеточных структур органов. В оценке ферментных тестов для диагностических целей особое значение имеет знание периода полужизни (полураспада) в плазме крови каждого из диагностических ферментов, что делает важным выбор точного времени для ферментного анализа крови. Весьма существенным является также знание особенностей распределения (топографии) ферментов в индивидуальных органах и тканях, а также их внутриклеточной локализации.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 642; Нарушение авторских прав?; Мы поможем в написании вашей работы!