
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Заболевания, связанные с нарушением синтеза и созревания коллагена 2 страница
|
|
|
|
165. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры.

На долю белков приходится примерно 40% от сухой массы головного мозга. Мозговая ткань является трудным объектом для изучения белкового состава вследствие большого содержания липидов и наличия белково-ли-пидных комплексов. А.Я. Данилевский впервые разделил белки мозговой ткани на растворимые в воде и солевых растворах белки и нерастворимые белки. Обширные исследования в этой области были проведены также А.В. Палладиным и сотр., которые разделили белки нервной ткани на 4 фракции: извлекаемые водой, 4,5% раствором КСl, 0,1% раствором NaOH и нерастворимый остаток. Установлено, что серое веществобогаче белками, растворимыми в воде, чем белое вещество,– соответственно 30 и 19%. Белое вещество, напротив, содержит гораздо больше (22%) нерастворимого белкового остатка, чем серое вещество (5%). В дальнейшем было выделено 5–10 фракций растворимых белков мозга, различающихся по своей электрофоретической подвижности. В настоящее время, сочетая методы экстракции буферными растворами, хроматографии на колонках с ДЭАЭ-целлюлозой и диск-электрофореза в полиакриламидном геле, удалось выделить из ткани мозга около 100 различных растворимых белковых фракций. В нервной ткани содержатся как простые, так и сложные белки. Простые белки – это альбумины (нейроальбумины), глобулины(нейроглобулины), катионные белки (гистоны и др.) и опорные белки (нейросклеропротеины). Альбумины и глобулины по своим физико-химическим свойствам несколько отличаются от аналогичных белков сыворотки крови, поэтому их называют нейроальбуминами и нейроглобулинами. Количество нейрогло-булинов в головном мозге относительно велико – в среднем 5% по отношению ко всем растворимым белкам. Нейроальбумины являются основным белковым компонентомфосфопротеинов нервной ткани, на их долю приходится основная масса растворимых белков (89–90%). В свободном состоянии нейроальбумины встречаются редко. В частности, они легко соединяются с липидами, нуклеиновыми кислотами, углеводами и другими небелковыми компонентами. Белки, которые в процессе электрофоретического разделения при рН 10,5–12,0 движутся к катоду, получили название катионных. Главнейшими представителями этой группы белков в нервной ткани являются гистоны, которые делятся на пять основных фракций в зависимости от содержания в их полипептидных цепях остатков лизина, аргинина и глицина.
Нейросклеропротеины можно охарактеризовать как структурно-опорные белки. Основные представители этих белков – нейроколлагены, нейроэлас-тины, нейростромины и др. Они составляют примерно 8–10% от общего количества простых белковнервной ткани и локализованы в основном в белом веществе головного мозга и в периферической нервной системе.
Сложные белки нервной ткани представлены нуклеопротеинами, липопротеинами, протеолипидами, фосфопротеинами,гликопротеинами и т.д. В мозговой ткани содержатся в значительном количестве еще более сложные надмолекулярные образования, такие, как липонуклеопротеины, липогликопротеины и, возможно, липогликонуклеопротеиновые комплексы.
Нуклеопротеины – белки, которые принадлежат либо к дезоксирибонук-леопротеинам, либо к рибонуклеопротеинам. Часть этих белковиз мозговой ткани извлекается водой, другая часть – солевыми средами, а третья – 0,1 М раствором щелочи.
Липопротеины составляют значительную часть водорастворимых белков мозговой ткани. Их липидный компонент – это в основномфосфоглицериды и холестерин.
Протеолипиды – это белково-липидные соединения, экстрагируемые органическими растворителями из ткани мозга. Отличаются от водорастворимых липопротеинов тем, что они нерастворимы в воде, но растворимы в смеси хлороформ–метанол. Белки, освобожденные от липидов, растворимы в воде, а также (благодаря высокому содержанию гидрофобных аминокислот) в смеси хлороформ–метанол. Наибольшее количество про-теолипидов сосредоточено в миелине, в небольших количествах они входят в состав синаптических мембран и синаптических пузырьков.
Фосфопротеины в головном мозге содержатся в большем количестве, чем в других органах и тканях,– около 2% от общего количества всех сложных белков мозга. Фосфопротеины обнаружены в мембранах различных морфологических структур нервной ткани.
Гликопротеины представляют собой чрезвычайно гетерогенную группу белков. По количеству белка и углеводов, входящих в состав гликопро-теинов, их можно разделить на две основные группы. Первая группа – это гликопротеины, содержащие от 5 до 40% углеводови их производных; белковая часть состоит преимущественно из альбуминов и глобулинов. В гликопротеинах, составляющих вторую группу, содержится 40–85% углеводов, часто обнаруживается липидный компонент; по своему составу они могут быть отнесены к гликолипопротеинам.
В нервной ткани обнаружен ряд специфических белков, в частности белок S-100 и белок 14-3-2. Белок S-100, или белок Мура, называют также кислым белком, так как он содержит большое количество остатков глутаминовой и аспарагиновой кислот. Этот белоксосредоточен в основном в нейроглии (85-90%), в нейронах его не более 10-15% от общего количества белка в головном мозге. Установлено, что концентрация белка S-100 возрастает при обучении (тренировках) животных. Пока нет оснований считать, что белокS-100 непосредственно участвует в формировании и хранении памяти. Не исключено, что его участие в этих процессах опосредованно.Белок 14-3-2 также относится к кислым белкам. В отличие от белка S-100 он локализован в основном в нейронах; в нейроглиальныхклетках его содержание невелико. Пока неясна роль белка 14-3-2 в выполнении специфических функций нервной ткани.
Ферменты. В мозговой ткани содержится большое количество ферментов, катализирующих обмен углеводов, липидов и белков. До сихпор в кристаллическом виде из ЦНС млекопитающих выделены лишь некоторые ферменты, в частности ацетилхолинэстераза и креатинкиназа.
Значительное количество ферментов в мозговой ткани находится в нескольких молекулярных формах (изоферменты): ЛДГ, альдолаза, креатинкиназа, гексокиназа, малатдегидрогеназа, глутаматдегидрогеназа, холинэстераза, кислая фосфатаза, моноаминоксидаза и др.
Среди химических компонентов головного мозга особое место занимают липиды, высокое содержание и специфическая природа которых придают мозговой ткани характерные особенности. В группу липидов головного мозга входят фосфоглицериды, холестерин,сфингомиелины, цереброзиды, ганглиозиды и очень небольшое количество нейтрального жира. Многие липиды нервной ткани находятся в тесной взаимосвязи с белками, образуя сложные системы типа протеолипидов.
В сером веществе головного мозга фосфоглицериды составляют более 60% от всех липидов, а в белом веществе – около 40%. Напротив, в белом веществе содержание холестерина, сфингомиелинов и особенно церебрози-дов больше, чем в сером веществе.
В мозговой ткани имеются гликоген и глюкоза, но по сравнению с другими тканями ткань мозга бедна углеводами. Общее содержаниеглюкозы в головном мозге разных животных составляет в среднем 1–4 мкмоль на 1 г ткани, а гликогена – 2,5–4,5 мкмоль на 1 г ткани. Интересно отметить, что общее содержание гликогена в мозге эмбрионов и новорожденных животных значительно выше, чем в мозге взрослых. Например, у новорожденных мышей в отличие от взрослых особей уровень гликогена в 3 раза выше. По мере роста и дифференцировки мозга концентрация гликогена быстро снижается и остается относительно постоянной у взрослого животного.
В мозговой ткани имеются также промежуточные продукты обмена углеводов: гексозо- и триозофосфаты, молочная, пировиноградная и другие кислоты.
В мозговой ткани на долю адениновых нуклеотидов приходится около 84% от всех свободных нуклеотидов. Большую часть оставшихсянуклеотидов составляют производные гуанина. В целом количество высокоэргических соединений в нервной ткани невелико. Содержание нуклеотидов и креатин-фосфата в головном мозге крыс составляет в среднем (в мкмоль на 1 г сырой массы): АТФ – 2,30–2,90; АДФ – 0,30–0,50; АМФ – 0,03–0,05; ГТФ – 0,20–0,30; ГДФ – 0,15–0,20; УТФ – 0,17–0,25; креатинфосфат – 3, 5 0 – 4,75. Распределение основных макроэргических соединений примерно одинаково во всех отделах мозга. Содержание циклических нуклеотидов (цАМФ и цГМФ) в головном мозге значительно выше, чем во многих других тканях. Уровень цАМФв мозге в среднем 1–2, а цГМФ – до 0,2 нмоль на 1 г ткани. Для мозга характерна также высокая активность ферментов метаболизмациклических нуклеотидов. Большинство исследователей считают, что циклические нуклеотиды участвуют в синаптической передаче нервного импульса.
Ионы Na+, K+, Cu2+, Fe3+, Ca2+, Mg2+и Мn2+ распределены в головном мозге относительно равномерно в сером и белом веществе. Содержание фосфатов в белом веществе выше, чем в сером. Количественное соотношение неорганических анионов и катионов в мозговой ткани свидетельствует о дефиците анионов. Расчет показывает, что для покрытия дефицита анионов потребовалось бы в 2 раза больше белков, чем их имеется в мозговой ткани. Принято считать, что остающийся дефицит анионов покрывается за счет липидов. Вполне возможно, что участие липидов в ионном балансе – одна из функций головного мозга.
Миелиновое вещество – понятие морфологическое. По сути миелин – это система, образованная многократно наслаивающимисямембранами клеток нейроглии вокруг нервных отростков (в периферических нервных стволах нейроглия представлена леммоцитами, или шванновскими клетками, а в белом веществе ЦНС – астроцитами).
По химическому составу миелиновое вещество является сложным белково-липидным комплексом.
На долю липидов приходится до 80% плотного осадка; 90% всех липидов миелина представлено холестерином, фосфолипидами и церебро-зидами. Считают, что в липоидных слоях миелиновых оболочек молекулы различных липидов имеют строго определенное расположение.
166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом. О размерах потребления головным мозгом из крови различных веществ, в том числе кислорода, можно судить по артериовенозной разнице. Установлено, что во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой тканиприходится 53–54 мл крови. Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 млкислорода. Газообмен мозга значительно выше, чем газообмен других тканей, в частности он превышает газообмен мышечной ткани почти в 20 раз. Интенсивность дыхания для различных областей головного мозга неодинакова. Например, интенсивность дыхания белого веществав 2 раза ниже, чем серого (правда, в белом веществе меньше клеток). Особенно интенсивно расходуют кислород клетки коры мозга и мозжечка. Поглощение кислорода головным мозгом значительно меньше при наркозе. Напротив, интенсивность дыхания мозга возрастает при увеличении функциональной активности.
Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Данный расчет, а также величина артериовенозной разницы по глюкозе доказывают, что основным субстратом дыхания головного мозга является глюкозакрови. По-видимому, глюкоза легко диффундирует из крови в ткань головного мозга (содержание глюкозы в мозговой ткани 0,05%, а в артериальной крови – 4,44 ммоль/л, или 80 мг/100 мл).
Между глюкозой и гликогеном мозговой ткани имеется тесная связь, выражающаяся в том, что при недостаточном поступлении глюкозыиз крови гликоген головного мозга является источником глюкозы, а глюкоза при ее избытке – исходным материалом для синтеза гликогена. Распад гликогена в мозговой ткани происходит путем фосфоролиза с участием системы цАМФ. Однако в целом использование гликогена в мозге по сравнению с глюкозой не играет существенной роли в энергетическом отношении, так как содержание гликогена в головном мозге невелико.
Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу. Значение этого явления пока недостаточно ясно, ибо гликолиз как источник энергии ни в коей мере не может сравниться по эффективности с тканевым дыханием в головном мозге.
Интенсивность обновления богатых энергией фосфорных соединений в головном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значительным постоянством. В случае прекращения доступакислорода мозг может «просуществовать» немногим более минуты за счет резерва лабильных фосфатов. Прекращение доступакислорода даже на 10–15 с нарушает энергетику нервных клеток, что в целостном организме выражается наступлением обморочного состояния. По-видимому, при кислородном голодании мозг может очень недолго получать энергию за счет процессов гликолиза.
Установлено, что при инсулиновой коме содержание глюкозы в крови может снижаться до 1 ммоль/л, потребление кислорода мозгом в этих условиях не более 1,9 мл/100 г в 1 мин. В норме концентрация глюкозы в крови 3,3–5,0 ммоль/л, а мозг потребляет 3,4–3,7 млкислорода на 100 г массы в 1 мин. При инсулиновой коме нарушаются процессы окислительного фосфорилирования в мозговой ткани, снижается концентрация АТФ и происходит изменение функций мозга. Возбуждение и наркоз быстро сказываются на обмене лабильных фосфатов. В состоянии наркоза наблюдается угнетение дыхания; содержание АТФ и креатинфосфата повышено, а уровень неорганического фосфата снижен. Следовательно, сокращается потребление мозгом соединений, богатых энергией. Напротив, при раздражении интенсивность дыхания усиливается в 2–4 раза; уровень АТФ и креатинфосфата снижается, а количествонеорганического фосфата увеличивается. Эти изменения наступают независимо от того, каким образом произошло стимулирование нервных процессов, а именно путем электрического разряжения или химическим путем.
Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутамино-вой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глу-тамином и трипептидом глутатиономприходится более 50% α-аминоазота головного мозга. В мозге содержится ряд свободных аминокислот, которые лишь в незначительных количествах обнаруживаются в других тканях млекопитающих. Это γ-аминомасляная кислота, N-ацетиласпарагиновая кислота и цистатионин.
Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислотиспользуется как источник «сырья» для синтеза белков и биологически активных аминов. Одна из функций дикарбоновых аминокислот в головном мозге – связывание аммиака, освобождающегося при возбуждении нервных клеток. Поступления аминокислот в мозговую ткань и выход из нее, а также использование глюкозы крови для синтеза аминокислот нейронов и глии в разных отделах мозга различны. Эти различия в существенной мере обусловлены наличием гематоэнцефалического барьера, который следует рассматривать конкретно для каждого вещества или класса веществ. Ге-матоэнцефалический барьер не следует представлять как единое структурное образование, создающее преграду для транспорта; различие относительно скоростей поступления веществ в разные отделы мозга может быть обусловлено особенностями эпителия сосудов, базальной мембраны или расположения прилегающих отростков глиальных клеток. В условиях in vitro (в отсутствие барьера) многие аминокислотынакапливаются в клетках мозга за счет активного транспорта, в котором участвует несколько самостоятельных Na+-зависимых транспортных систем. Установлено, что белки в головном мозге находятся в состоянии активного обновления, о чем свидетельствует быстрое включение радиоактивных аминокислот в молекулы белков. Однако в разных отделах головного мозга скорость синтеза и распада белковыхмолекул неодинакова. Белки серого вещества полушарий большого мозга и белки мозжечка отличаются особенно большой скоростью обновления. В участках головного мозга, богатых проводниковыми структурами – аксонами (белое вещество головного мозга), скорость синтеза и распада белковых молекул меньше. При различных функциональных состояниях ЦНС наступают изменения в интенсивности обновления белков. Так, при действии наорганизм животных возбуждающих агентов (фармакологические средства и электрический ток) в головном мозге усиливается интенсивность обмена белков. Под влиянием наркоза скорость распада и синтеза белков снижается. Возбуждение нервной системы сопровождается повышением содержания аммиака в нервной ткани. Это явление наблюдается как при раздражении периферических нервов, так и при раздражении мозга. Считают, что образование аммиака при возбуждении в первую очередь происходит за счет дезаминирования АМФ. Аммиак – очень ядовитое вещество, особенно для нервной системы. Особую роль в устранении аммиака играет глутаминовая кислота. Она способна связывать аммиак с образованием глутамина – безвредного для нервной ткани вещества. Данная реакция амидирования протекает при участии фермента глутаминсинтетазы и требует затраты энергии АТФ. Непосредственный источникглутаминовой кислоты в мозговой ткани – путь восстановительного аминирования α-кетоглутаровой кислоты;

Образование глутаминовой кислоты из α-кетоглутаровой и аммиака является важным механизмом нейтрализации аммиака в тканимозга, где путь устранения аммиака за счет синтеза мочевины не играет существенной роли. Кроме того, глутаминовая кислота в нервной ткани может декарбокси-лироваться с образованием ГАМК:
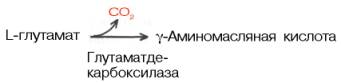
ГAMК в наибольшем количестве содержится в сером веществе головного мозга. В спинном мозге и периферических нервах ее значительно меньше.
Липиды составляют около половины сухой массы головного мозга. Как отмечалось, в нервных клетках серого вещества особенно много фосфо-глицеридов, а в миелиновых оболочках нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен ли-пидов миелиновых оболочек протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно.
Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в головном мозге всего 2 гхолестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза), при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифици-рованном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках активной миелинизации. Пути биосинтеза фосфоглицеридов в мозге сходны с теми, которые осуществляются в других тканях. Жирные кислоты образуются в основном из глюкозы, однако частично синтез их происходит из ацетоацетата, цитрата и даже ацетил-аспартата.
167. Биохимия возникновения и проведения нервного импульса. Молекулярные механизмы синаптической передачи
Большинство исследователей придерживаются мнения, что явления электрической поляризации клетки обусловлены неравномерным распределением ионов К+ и Na+по обе стороны клеточной мембраны. Мембрана обладает избирательной проницаемостью: большей для ионов К+ и значительно меньшей для ионов Na+. Кроме того, в нервных клетках существует механизм, который поддерживает внутриклеточное содержание натрия на низком уровне вопреки градиенту концентрации. Этот механизм получил название натриевого насоса. При определенных условиях резко повышается проницаемость мембраны для ионов Na+. В состоянии покоя внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности. Объясняется это тем, что количество ионов Na+, выкачиваемых из клетки с помощью натриевого насоса, не вполне точно уравновешивается поступлением в клетку ионов К+. В связи с этим часть катионов натрия удерживается внутренним слоем противоионов (анионов) на наружной поверхности клеточной мембраны. Таким образом, на мембранах, ограничивающих нервные клетки, поддерживается разность электрических потенциалов (трансмембранная разность электрических потенциалов); эти мембраныэлектрически возбудимы. При возбуждении, вызванном тем или иным агентом, селективно изменяется проницаемость мембраны нервной клетки (аксона): увеличивается избирательно для ионов Na+(примерно в 500 раз) и остается без изменения для ионов К+. В результате ионыNa+устремляются внутрь клетки. Компенсирующий поток ионов К+, направляющийся из клетки, несколько запаздывает. Это приводит к возникновению отрицательного заряда на наружной поверхности клеточной мембраны. Внутренняя поверхность мембраныприобретает положительный заряд; происходит перезарядка клеточной мембраны (в частности, мембраны аксона, т.е. нервного волокна), и возникает потенциал действия, или спайк. Продолжительность спайка не превышает 1 мс. Он имеет восходящую фазу, пик и нисходящую фазу. Нисходящая фаза (падение потенциала) связана с нарастающим преобладанием выхода ионов К+ над поступлениемионов Na+– мембранный потенциал возвращается к норме. После проведения импульса в клетке восстанавливается состояние покоя. В этот период ионы Na+, вошедшие в нейрон при возбуждении, заменяются на ионы К+. Этот переход происходит против градиентаконцентрации, так как ионов Na+во внешней среде, окружающей нейроны, намного больше, чем в клетке после момента ее возбуждения. Переход ионов Na+против градиента концентрации, как отмечалось, осуществляется с помощью натриевого насоса, для работы которого необходима энергия АТФ. В конце концов все это приводит к восстановлению исходной концентрации катионов калияи натрия внутри клетки (аксона), и нерв готов для получения следующего импульса возбуждения. Заметим, что миелиновые мембраны, образуемые шванновскими клетками, окутывают нервные волокна и служат электрическим изолятором. Этот изоляционный слой покрывает большинство нервных волокон и сильно ускоряет распространение электрической волны (сигнала); при этом ионы входят вклетку и выходят из нее только в тех местах, где изолятор отсутствует. Как уже отмечалось, миелиновая мембрана состоит из фос-фолипидов, в частности из сфингомиелина, холестерина, а также белков и гликосфинголипидов. Некоторые заболевания, например рассеянный склероз, характеризуются демиелинизацией и нарушением проведения нервного импульса. Другим не менее важным процессом для нервной ткани является передача нервного импульса от одной нервной клетки к другой или воздействие на клетки эффекторного органа.
168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
Ацетилхолин является химическим передатчиком (медиатором) нервного возбуждения; окончания нервных волокон, для которых он служит медиатором, называются холинергическими, а рецепторы, взаимодействующие с ним, называют холинорецепторами. Холинорецептор (по современной зарубежной терминологии — «холиноцептор») является сложной белковой макромолекулой (нуклеопротеидом), локализованной на внешней стороне постсинаптической мембраны. При этом холинорецептор постганглионарных холинергических нервов (сердца, гладких мышц, желез) обозначают как м-холинорецепторы (мускариночувствительные), а расположенные в области ганглионарных синапсов и в соматических нервномышечных синапсах — как н-холинорецепторы (никотиночувствительнные). Такое деление связано с особенностями реакций, возникающих при взаимодействии ацетилхолина с этими биохимическими системами: мускариноподобных в первом случае и никотиноподобных — во втором; м- и н-холинорецепторы находятся также в разных отделах ЦНС.
Катехоламины — физиологически активные вещества, выполняющие роль химических посредников и «управляющих» молекул (медиаторов и нейрогормонов) в межклеточных взаимодействиях у животных и человека, в том числе в их мозге; производные пирокатехина. К катехоламинам относятся, в частности, такие нейромедиаторы, как адреналин, норадреналин, дофамин (допамин).
γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКA- и ГАМКC-рецепторов, приводящая к ингибированию нервного импульса. становлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения.
Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение.
Действие ГАМК в ЦНС осуществляется путём её взаимодействия со специфическими ГАМКергическими рецепторам
Глутаминовая кислота является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание аниона глутамината со специфическими рецепторами нейронов приводит к возбуждению нейронов. Существуют ионотропные и метаботропные (mGLuR 1-8) глутаминатные рецепторы.
Ионотропными рецепторами являются NMDA-рецепторы, AMPA-рецепторы и каинатные рецепторы.
Эндогенные лиганды глутаминатных рецепторов — глутаминовая кислота и аспарагиновая кислота. Для активации НМДА рецепторов также необходим глицин. Блокаторами NMDA-рецепторов являются PCP, кетамин, и другие вещества. AMPA-рецепторы также блокируются CNQX,NBQX. Каинова кислота является активатором каинатных рецепторов.
Глицин является нейромедиаторной аминокислотой. Рецепторы к глицину имеются во многих участках головного мозга и спинного мозга и оказывают «тормозное» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких, как глутаминовая кислота, и повышают выделение ГАМК.
Серотонин играет роль нейромедиатора в ЦНС. Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. От моста идут нисходящие проекции в спинной мозг, нейроны ядер шва дают восходящие проекции к мозжечку, лимбической системе, базальным ганглиям, коре. При этом нейроны дорсального и медиального ядер шва дают аксоны, различающиеся морфологически, электрофизиологически, мишенями иннервации и чувствительностью к некоторым нейротоксическим агентам, например, экстази.
169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы) ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам относятся дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин (синтезируются из триптофана) и многие другие соединения. В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов.
В терапевтической практике применяется большое количество лекарственных средств, которые действуют через систему медиаторов. Многие лекарственные препараты, успешно применяемые при лечении гипертонии, влияют на накопление и выделение адренергических медиаторов. Например, резерпин – понижающее артериальное давление средство специфически тормозит процесс переноса катехоламинов в специальные гранулы нейронов и тем самым делает эти амины доступными действию эндогенной МАО.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1003; Нарушение авторских прав?; Мы поможем в написании вашей работы!