
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения
|
|
|
|
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
· специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
· высокая электропроводность;
· высокая теплопроводность;
· пластичность;
· отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек - электронов. В ядре атома находятся положительно заряженные частицы - протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
1) Объемно - центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
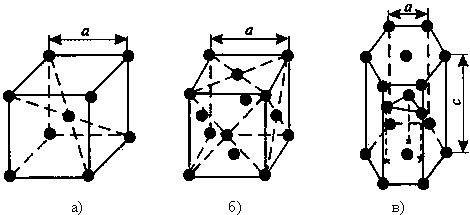
Рисунок 1 - Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t<911°С – ОЦК - Feα; 911< t <1392°С – ГЦК - Feβ; 1392< t >1539°С – ОЦК - Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).
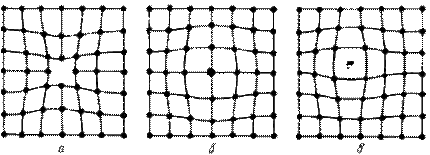
Рисунок 2 - Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
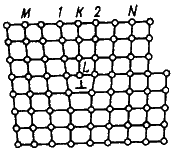 Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Дислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 - Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1355; Нарушение авторских прав?; Мы поможем в написании вашей работы!