
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цитохромы
|
|
|
|
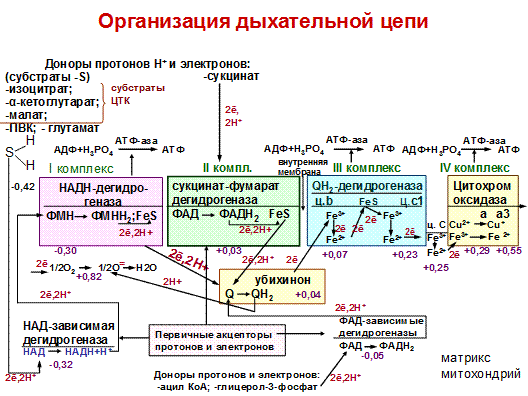
Организация дыхательной цепи. Переносчики в дыхательной цепи (ЦПЭ).
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса. Компоненты комплексов расположены в строго определенной последовательности, в порядке возрастания их окислительно-восстановительных потенциалов (редокс-потенциалов). Величина редокс-потенциала связана с изменением свободной энергии. Её выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство, тем больше восстановительный потенциал.
I комплекс – НАДН-дегидрогеназа – состоит из нескольких полипептидных цепей.
В I комплекс входят две простетические группы: ФМН и FeS (железо-серные белки). Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железо-серных центров. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в котором атом железа связан с атомом серы остатками цистеина или неорганической серы.
На I комплекс протоны и электроны от субстратов (изоцитрат, малат и др.) транспортирует главный первичный акцептор водорода – НАД-зависимая дегидрогеназа (восстановленная форма НАДН+Н+). НАДН+Н+ - два электрона и один протон переносятся на ФМН простетическую группу I комплекса с образованием ФМНН2. Второй протон поглощается из матрикса. С ФМНН2 электроны и протоны транспортируются на FeS. От железо-серных центров электроны и протоны переносятся на кофермент Q (убихинон).
II комплекс – сукцинат-фумарат-дегидрогеназа. Состоит из 2 простетических групп: ФАД и FeS. На ФАД электроны и протоны отщепляются от субстрата – сукцинат, при этом ФАД восстанавливается в ФАДН2. Затем протоны и электроны передаются на FeS, с FeS они транспортируется на убихинон.
Убихинон - (вездесущий хинон) или кофермент Q. Это небелковый переносчик. Он является жирорастворимым соединением. Структура КоQ сходна с витаминами К, Е.
Молекулы убихинона различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10.
Убихинон выполняет коллекторную функцию, присоединяя ē и протоны от НАДН-дегидрогеназы (I комплекс), сукцинат-фумаратдегидрогеназы (II комплекс) и ФАД- зависимых дегидрогеназ, он обратимо восстанавливается в гидрохинон (QН2).
Содержание убихинона значительно превосходит количество других компонентов ЦПЭ. Например, на 1 молекулу НАД+ приходится 50молекул КоQ.
От убихинона происходит транспорт только электронов на цитохромы.
Обнаружены в 1886г. Мак-Мунном, исследованы в 1925г. Девидом Кейлином.
Цитохромы – это сложные белки-гемопротеины, которые в качестве простетической группы содержат гем.
Известно около 30 различных цитохромов.
Их многообразие обусловлено:
- различием боковых цепей в структуре гема;
- различием в структуре полипептидных цепей;
- различием в способе связи полипептидных цепей с гемом.
В зависимости от способности поглощать свет в различной части спектра все цитохромы делятся на группы а, в, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами (в, в1, в2 и т.д.)
Цитохромы имеют ряд особенностей:
1. Цитохромы в ЦПЭ располагаются в порядке возрастания окислительно-восстановительного потенциала (редокс-потенциала);
2. Железо в цитохромах способно изменять свою степень окисления, поэтому цитохромы в ЦПЭ транспортируют только электроны.
В транспорте двух электронов принимают участие две молекулы каждого вида цитохромов, так как одна молекула цитохрома может переносить только один электрон.
В ЦПЭ участвуют 5 типов цитохромов- а, а3, в, с, с1. За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов.
III комплекс – QН2-дегидрогеназа состоит из 2 типов цитохромов (в1 и в2), цитохрома с1 и FeS. Внутри комплекса электроны передаются от цитохромов в на FeS-центры, затем на цитохром с1. С цитохрома с1 электроны транспортируются на цитохром С.Это периферический водорастворимый мембранный белок с молекулярной массой 12500Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков и молекулу гема, ковалентно связанную с полипептидом. От цитохрома С электроны переносятся на IV комплекс.
IV комплекс – цитохромоксидаза входят два цитохрома типа аа3, каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют в своей структуре гем А, отличающийся от гема цитохромов с и с1. Он содержит формильную группу вместо одной из метильных групп и углеводородную цепь вместо одной из винильных групп.
Другая особенность комплекса аа3 – наличие в нем ионов меди, связанных с белковой частью в так называемых CuA- центрах. Перенос электронов комплексом а-а3 включает реакции:
 Cu+ Cu2+ + ē
Cu+ Cu2+ + ē
 Fe2+ Fe3+ + ē
Fe2+ Fe3+ + ē
Комплекс цитохромов а-а3 транспортирует электроны непосредственно на молекулярный кислород, активируя его:
аа3 2ē ½ О2 О=
 |  |
У активированного кислорода появляются две свободные валентности, к которым присоединяются 2 протона Н+ от первичных акцепторов водорода: НАД-зависимых дегидрогеназ, ФАД-зависимых дегидрогеназ; сукцинат-фумарат-дегидрогеназы (II комплекс) через убихинон (QН2).
|
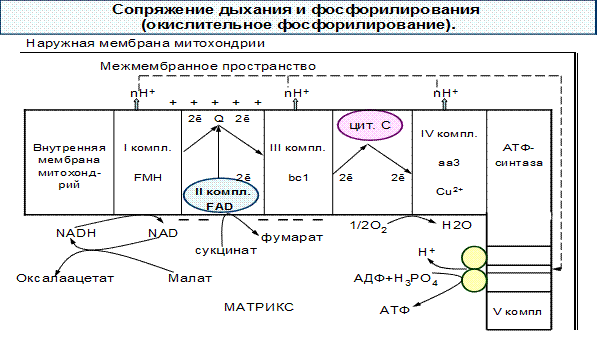
2.6. Окислительное фосфорилирование АДФ. Механизм сопряжения окисления и фосфорилирования. Коэффициент окислительного фосфорилирования (Р/О).
Так как электроны всегда стремятся переходить от электроотрицательных систем к электроположительным, их транспорт по ЦПЭ к кислороду сопровождается относительно большим снижением свободной энергии.
В ЦПЭ можно выделить 3 участка, в которых перенос электронов сопровождается относительно большим снижением свободной энергии. Это количество свободной энергии необходимо для синтеза АТФ из АДФ и фосфата (фосфорилирование).
Процесс переноса электронов по ЦПЭ и синтез АТФ энергетически сопряжены.
Синтез АТФ из АДФ и Н3РО4 за счет энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Механизм сопряжения окончательно не выяснен, наиболее обоснованной является хемиосмотическая теория Митчелла, предложенная в 1961г.
Перенос электронов по ЦПЭ от НАДН к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство.
Протоны, перенесенные из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана не проницаема для протонов.
Таким образом, создается протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несет положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд – на внутренней стороне, положительный заряд – на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ.
Энергия электрохимического потенциала (ΔμН+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы (V комплекс).
Наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+ происходит на участках ЦПЭ, соответствующих расположению комплексов I, III, IV. Эти участки называют пунктами сопряжения дыхания и фосфорилирования, где и происходит синтез АТФ.
V комплекс – АТФ-синтаза.
Это интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из двух белковых комплексов.
Гидрофобный комплекс F◦ погружен в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране.
Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в матрикс. Он состоит из 9 субъединиц. Между α- и β- субъединицами располагаются три активных центра, в которых происходит синтез АТФ.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμН+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμН+ происходят конформационные изменения в парах α- и β- субъединиц белка F1 , в результате чего из АДФ и Н3РО4 образуется АТФ. Электрохимический потенциал, генерируемый в 3 пунктах сопряжения в ЦПЭ, используется для синтеза одной молекулы в каждом пункте.
Отношение количества Н3РО4, использованной на фосфорилирование АДФ, к атому поглощенного кислорода, называют коэффициентом окислительного фосфорилирования и обозначают Р/О.
Для субстратов, которые отдают протоны и электроны на НАД-зависимые дегидрогеназы, коэффициент фосфорилирования равен 3/1=3АТФ, так как протоны и электроны транспортируются через 3 пункта сопряжения (I, III, IV комплексы).
Например, изоцитрат, малат, ПВК и др.
Для субстратов, которые отдают протоны и электроны на ФАД-зависимые дегидрогеназы и сукцинат-фумарат-дегидрогеназу (II комплекс), коэффициент фосфорилирования равен 2/1=2АТФ, так как электроны поступают на III комплекс, минуя первый пункт сопряжения (I комплекс). Например, сукцинат, глицерол-3-фосфат и др.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 4004; Нарушение авторских прав?; Мы поможем в написании вашей работы!