
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Генная инженерия и ее инструменты
|
|
|
|
Генную инженерию составляет совокупность различных экспериментальных приемов (методик), обеспечивающих конструкцию (реконструкцию), клонирование молекул ДНК и генов с заданными целями.
Методы генной инженерии используют в определенной последовательности (рис. 127), причем различают несколько стадий в выпол-
нении типичного генно-инженерного эксперимента, направленного на клонирование какого-либо гена, а именно:
1. Выделение плазмидий ДНК из клеток интересующего организма (исходного) и выделение ДНК-вектора.
2. Разрезание (рестрикция) ДНК исходного организма на фрагменты, содержащие интересующие гены, с помощью одного из ферментов-рестриктаз и выделение этих генов из рестрикционной смеси. Одновременно разрезают (рестрицируют) векторную ДНК, превращая ее из кольцевой структуры в линейную.
3. Смыкание интересующего сегмента ДНК (гена) с ДНК вектора с целью получения гибридных молекул ДНК.
4. Введение рекомбинантных молекул ДНК путем трансформации в какой-либо другой организм, например в Е. coli или соматические клетки.
5. Высев бактерий, в которые вводили гибридные молекулы ДНК, на питательные среды, позволяющие рост только клеток, содержащих гибридные молекулы ДНК.
6. Идентификация колоний, состоящих из бактерий, содержащих гибридные молекулы ДНК.
7. Выделение клонированной ДНК (клонированных генов) и ее характеристика, включая секвентирование азотистых оснований в клонированном фрагменте ДНК.

Рис. 127. Последовательные стадии генно-инженерного эксперимента
В ходе эволюции бактерии развили способность синтезировать так называемые рестрицирующие ферменты (эндонуклеазы), которые стали частью клеточной (бактериальной) системы рестрикциимодификации. У бактерий системы рестрикции-модификации являются внутриклеточной иммунной системой защиты от чужеродной ДНК. В отличие от высших организмов, у которых распознание и разрушение вирусов, бактерий и других патогенов происходит внеклеточно, у бактерий защита от чужеродной ДНК (ДНК растений и животных, в организме которых они обитают) происходит внутриклеточно, т.е. тогда, когда чужеродная ДНК проникает в цитоплазму бактерий. С целью защиты бактерии в ходе эволюции развили также способность «метить» собственную ДНК метилирующими основаниями на определенных последовательностях. По этой же причине чужеродная ДНК из-за отсутствия в ней метильных групп на тех же последовательностях плавится (разрезается) на фрагменты разными бактериальными рестриктазами, а затем деградируется бактериальными экзонуклеазами до нулеотидов. Можно сказать, что таким образом бактерии защи- щают себя от ДНК растений и животных, в организме которых они обитают временно (как патогены) или постоянно (как сапрофиты).
Рестриктазы впервые были выделены из Е. coli в 1968 г. Оказалось, что они способны разрезать (плавить) молекулы ДНК на разных сайтах (местах) рестрикции. Эти ферменты получили название эндонуклеаз класса I. Затем у бактерий были обнаружены эндонуклеазы класса II, которые распознают в чужеродной ДНК сайты рестрикции специфически и на этих сайтах тоже осуществляют рестрикцию. Именно ферменты этого класса стали использовать в генной инже- нерии. Тогда же были открыты ферменты класса III, которые плавят ДНК рядом с сайтами распознания, но эти ферменты не имеют значения в генной инженерии.
Действие системы рестрикции-модификации «рационализуется» так называемыми палиндромными (распознающими) последователь- ностями азотистых оснований, которые являются сайтами рестрикции ДНК. Палиндромные последовательности - это последовательности оснований, которые одинаково читаются вперед и назад, как, например, последовательность букв радар. Поскольку цепи ДНК обладают антипараллельным направлением, то считают, что последовательность является палиндромной, если она идентична, когда читается в направлении от 5' - к 3'-концу на верхней и на нижней цепи от 3' - к 5'-концу, а именно:

Палиндромы могут быть любых размеров, но большинство тех палиндромов, которые используют в качестве сайтов узнавания рестриктазами, состоят из 4, 5, 6 и реже 8 оснований.
Рестриктазы - это абсолютно необходимый инструмент в генной инженерии для вырезания интересующих фрагментов (генов) из больших молекул ДНК. Поскольку известно более 100 ферментов рестрикции, то это позволяет выбор рестриктаз и селективное вырезание фрагментов из исходной ДНК.
Замечательной особенностью рестриктаз является то, что они продуцируют разрезы молекул на несколько фрагментов (рестриктов) ДНК уступами, в результате чего в образующихся концах одна цепь длиннее другой, образуя своеобразный хвост. Такие концы (хвосты) получили название «липких» концов, так как они способны к самокомплементарности.
Рассмотрим результаты рестрикции на примере одной из наиболее известных рестриктаз Eco RI из системы рестрикция-модификация Е. соИ. Вместо того чтобы плавить ДНК в центре палиндромной последовательности узнавания, этот фермент плавит ДНК за преде- лами центра и продуцирует 4 самокомплементарных («липких») конца, состоящих из разного количества нуклеотидов, а именно:

Эти «липкие» концы в генно-инженерных опытах полезны по той причине, что они могут быть воссоединены комплементарно при низких температурах, что позволяет эффективное смыкание ДНК-фрагментов.
Сайты распознавания и сайты плавления в случае других рестриктаз имеют другое содержание, а именно:

Вслед за рестрикцией ДНК из рестрикционной смеси выделяют рестрикционные ДНК-фрагменты (ДНК-рестрикты), которые необ- ходимы затем для объединения с вектором. Для выделения ДНКрестриктов прибегают к электрофорезу, поскольку с помощью этого метода рестрикцированную ДНК очень легко фракционировать благодаря размерам фрагментов-рестриктов и константным отношениям электрический заряд-масса. Фрагменты в электрическом поле мигрируют в ходе электрофореза при частоте, зависимой от их размеров (массы). Чем больше (длиннее) фрагмент, тем медленнее он мигрирует в электрическом поле. Материалом, в котором проводят электрофорез, являются незаряжающиеся агароза или полиакриламид. Для опознания фрагментов используют этидий бромид, который красит фрагменты, что ведет к их более легкому обнаружению.
Результативность электрофореза очень высока, поскольку с его помощью могут быть разделены фрагменты, размеры которых состав- ляют от 2 до 50 000 оснований.
После электрофореза фрагменты из агарозы выделяют с помощью разных методов. На основании результатов сравнения размеров
рестриктов одной и той же ДНК, полученных с помощью разных рестриктаз, строят рестрикционные карты, на которых показывают сайты рестрикции каждой из использованных рестриктаз. В практическом плане рестрикционные карты позволяют определять не только размеры рестриктов, но и выяснять расположение в молекулах ДНК локусов тех или иных генов.
Поскольку у высших организмов в ходе транскрипции синтезируется гетерогенная ДНК, корректируемая процессингом, то в генной инженерии обычно используют комплементарную ДНК (кДНК), которую получают при использовании в качестве матрицы мРНК, на которой обратная транскриптаза синтезирует одноцепочечную ДНК (кДНК), являющуюся копией мРНК. В последующем эти одноцепочечные ДНК превращают в двухцепочечные ДНК. Считают, что кДНК содержит непрерывные нуклеотидные последовательности (транскрибируемые и транслируемые). Именно кДНК используют для рестрикции.
Выделенные после электрофореза из агарозных гелей фрагменты ДНК (рестрикты) можно предварительно подвергнуть сек-вентированию, т.е. определить в них нуклеотидную последовательность. Для этого служат химический и ферментативный методы секвентирования. Химический метод основан на получении меченных радиоактивным фосфором (32Р) фрагментов и удалении из этих фрагментов одного из оснований с последующим учетом результатов радиоавтографии гелей, содержащих эти фрагменты. Ферментативный метод основан на том, что в конец анализируемого фрагмента вводят нуклеотид, используемый затем в синтезе разных фрагментов in vitro, анализируемых на нуклеотидную последовательность электрофоретически. Для изучения специфических последовательностей нуклеотидов в молекуле ДНК используют
также гибридизацию ДНК-ДНК, РНК-РНК, ДНК-РНК, Нозерн-
и Саузерен-блоттинги.
Генетические векторы. Сегмент ДНК (ген), который предназначен для молекулярного клонирования, должен обладать способностью к репликации при переносе его в бактериальную клетку, т.е. быть репликоном. Однако он такой способностью не обладает. Поэтому, чтобы обеспечить перенос и обнаружение клонируемых генов в клетках, их объединяют с так называемыми генетическими векторами. Последние должны обладать как минимум двумя свойствами. Во-первых, векторы должны быть способны к репликации
в клетках, причем в нескольких концах. Во-вторых, они должны обеспечивать возможность селекции клеток, содержащих вектор, т.е. обладать маркером, на который можно вести контрселекцию клеток, содержащих вектор вместе с клонируемым геном (рекомбинантные молекулы ДНК). Таким требованиям отвечают плазмиды и фаги. Плазмиды являются хорошими векторами по той причине, что они являются репликонами и могут содержать гены резистентности к какому-либо антибиотику, что позволяет вести селекцию бактерий на устойчивость к этому антибиотику и, следовательно, легкое обнаружение рекомбинантных молекул ДНК
(рис. 128).
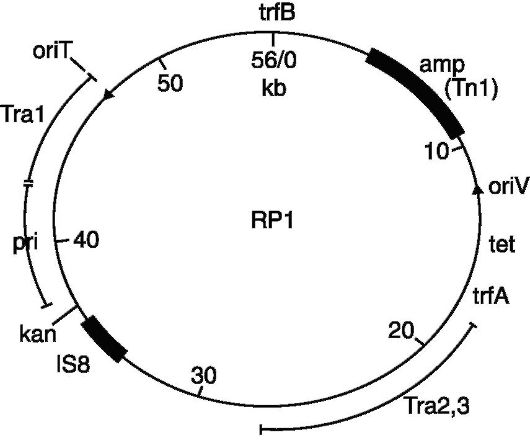
Рис. 128. Вектор pBRl
Поскольку не существует природных плазмидных векторов, то все известные к настоящему времени плазмидные векторы были сконструированы искусственно. Исходным материалом для создания ряда генетических векторов послужили R-плазмиды, в которых с помощью рестриктаз удаляли излишние последовательности ДНК, в том числе те, на которых располагались множественные сайты рестрикции. Это удаление определялось тем, что плазмидный вектор должен обладать только одним сайтом узнавания для одной рестриктазы, причем этот сайт должен лежать в функционально несущественном районе плазмидного генома. Например, плазмидый вектор pBR 322, который имеет гены резистентности к ампициллину и тетрациклину, что делает его очень удобным
для селекции бактерий, содержащих клонируемый сегмент ДНК, обладает одиночными сайтами рестрикции для более 20 ферментов- рестриктаз, включая такие известные рестриктазы, как Eco RI, Hind III, Pst I, Pva II и Sal I.
Фаговые векторы тоже обладают рядом преимуществ. Они могут включать в себя более крупные (более длинные) клонируемые фрагменты ДНК по сравнению с плазменными векторами. Далее, перенос фагами клонируемого фрагмента в клетки в результате инфицирования ими последних является более эффективным, чем трансформация ДНК. Наконец, фаговые векторы позволяют более эффективный скрининг (распознание) на поверхности агара колоний, содержащих клетки, несущие клонируемый ген. Многие фаговые векторы сконструированы на базе фага лямбда.
Кроме фаговых используют и другие вирусные векторы, сконструированные на базе вируса герпеса, а также векторы, сконструированные на базе дрожжевой ДНК.
Если клонирование генов проводят, используя клетки млекопитающих или растений, то требования к векторам те же, что и в случае клонирования в бактериальных клетках.
Конструирование рекомбинантных молекул ДНК. Непосредственное конструирование рекомбинантных молекул ДНК следует после того, как получены рестрикты исследуемой ДНК и векторной ДНК. Оно заключается в смыкании сегментов-рестриктов исследуемой ДНК с рестриктом векторной ДНК, которая в результате рестрикции превращается из кольцевой в линейную ДНК.
Чтобы сомкнуть фрагменты исследуемой ДНК с ДНК вектора, используют ДНК-лигазу (рис. 129). Лигирование будет успешным, если смыкаемые структуры обладают З'-гидроксильной и 5'-фос- фатной группами и если эти группы расположены соответствующим образом относительно одна другой. Фрагменты объединяются через их «липкие» концы в результате самокомплементарности. При высоких концентрациях фрагментов последние время от времени становятся в правильное положение (напротив друг друга). Многие рестриктазы, такие как Eco RI, продуцируют «липкие» концы, состоящие из четырех оснований. Процесс лигирования «липких» концов, состоящих из четырех оснований, происходит при пониженной температуре (до 12?С).
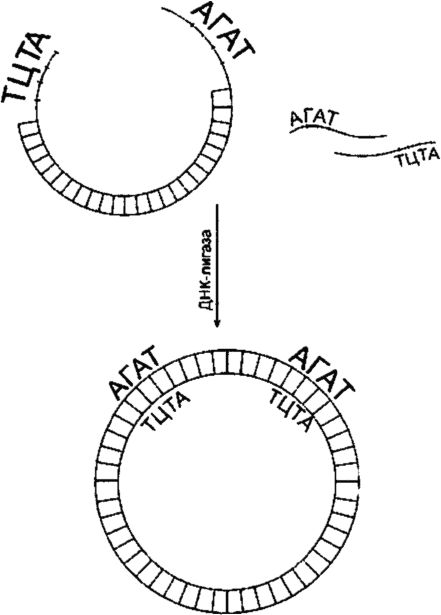
Рис. 129. ДНК-лигирование
Если при рестрикции образуются фрагменты без «липких» концов, то их «насильственно» конвертируют в молекулы с «липкими» концами, используя фермент трансферазу. Этот фермент добавляет нуклеотиды к 3'-концу ДНК. На одном фрагменте может быть добавлен поли-А-хвост, на другом - поли-Т-хвост. Для генерации любых желаемых концов ДНК используют также полимеразную цепную реакцию (ПЦР). Принцип ПЦР основан на денатурации выделенной из клеток ДНК и «отжиге» ее с добавлением к ренатурирующимся цепям ДНК-олигонуклеотидов, состоящих из 15-20 нуклеотидов каждый. Эти олигонуклеотиды должны быть комплементарны последовательностям в цепях, разделенных расстояниями в 50-2000 нуклеотидов. Будучи «затравкой» для синтеза ДНК in vitro, они позволяют ДНК-полимеразе копировать те участки, которые находятся между «затравками». Это копирование дает большое количество копий изучаемого фрагмента ДНК.
Введение рекомбинантных молекул ДНК в клетки. После смыкания интересующего фрагмента ДНК (гена) с генетическим вектором с помощью ДНК-лигазы образованные рекомбинантные молекулы вводят в клетки с целью добиться их репликации (за счет генетического вектора) и увеличения количества копий. Наиболее популярным способом введения в клетки рекомбинантных молекул ДНК, в которых вектором служит плазмида, является трансформация Е. coli. С этой целью бактериальные клетки предварительно обрабатывают кальцием или рубидием (ионами), для того
чтобы они стали «компетентными» в восприятии рекомбинатной ДНК. Чтобы повысить частоту проникновения ДНК в клетки, используют метод электропорации, заключающийся в кратком экспонировании клеток в интенсивном электрическом поле. Эта обработка создает полости в мембранах клеток, что способствует лучшему восприятию клетками ДНК. После введения рекомбинатных молекул ДНК в бактерии последние высевают на МПА (мясо-пептонный агар), обогащенный антибиотиками для селекции желаемых клеток, т.е. клеток, содержащих рекомбинантные молекулы ДНК. Частота трансформации является невысокой. Обычно один трансформант возникает на 105 высеянных клеток. Если же вектор является фаговым, то прибегают к трансфекции клеток (бактерий или дрожжей) фагом. Что касается соматических клеток животных, то их трансфекцию осуществляют ДНК в присутствии химических веществ, облегчающих прохождение ДНК через плазматические мембраны. Возможны также прямые микроинъекции ДНК в овоциты, в культивируемые соматические клетки и в эмбрионы млекопитающих.
Важнейшим моментом, связанным с молекулярным клонированием, является поиск способа, позволяющего установить, действитель- но ли клонируемый фрагмент включился в вектор и вместе с вектором, образовав рекомбинатную молекулу ДНК, вошел в клетки. Если речь идет о бактериальных клетках, то один из способов основан на учете инсерционной инактивации плазмидного (векторного) гена резистентности. Например, в плазмидном векторе pBR 322, детерминирующем резистентность к ампициллину и тетрациклину, един- ственный сайт для рестриктазы Pst I находится в локусе, занимаемом геном резистентности к ампициллину. Pst I-плавление на этом сайте генерирует «липкие» концы, позволяющие лигирование клонируемого фрагмента с векторной ДНК. Однако при этом плазмидный (векторный) ген ампициллинрезистентности инактивируется, тогда как ген тетрациклинрезистентности на векторе остается интактным. Именно ген тетрациклинрезистентности и используется для селекции клеток, трансформируемых рекомбинантными молекулами ДНК. Это позволяет убедиться, что клетки выросших колоний на среде с тетрациклином действительно содержат рекомбинантные молекулы ДНК, их проверяют с помощью так называемого «спот-теста» на паре чашек с плотной средой, одна из которых содержит ампициллин, тогда как другая лишена этого антибиотика. Клонируемые ДНК находятся
лишь в трансформантах, резистентных к тетрациклину. Что касается трансформантов, резистентных одновременно к ампициллину и тетрациклину (АрТс), то они содержат плазмидные (векторные) молекулы, которые спонтанно приобрели кольцевую форму без включения в них чужеродной (клонируемой) ДНК.
Другой способ обнаружения инсерции чужеродных (клонируемых) фрагментов в плазмидный вектор основан на использовании вектора, содержащего ген β-галактозидазы. Инсерция чужеродной ДНК в этот ген неизбежно инактивирует синтез β-галактозидазы, что может быть обнаружено посевом трансформированных клеток на среду, которая содержит субстраты β-галактозидазы. Эта среда позволяет селекцию окрашенных колоний клеток. Существуют и другие методы.
Как уже отмечено, рестрикционные линейные фрагменты векторной ДНК способны к восстановлению кольцевой структуры без включения в них клонируемых сегментов. Чтобы уменьшить частоту спонтанного образования таких кольцевых молекул векторной ДНК, рестрикты векторной ДНК обрабатывают фосфатазой. В результате этого образование кольцевых молекул ДНК становится невозможным, поскольку будут отсутствовать концы 5'-РО4, необходимые для действия лигазы.
Совокупность колоний-трансформантов, выросших на селективной среде, представляет собой совокупность клеток, содержащих клоны разных фрагментов (генов) клонируемой геномной или кДНК. Коллекции этих клонов формируют так называемые библиотеки ДНК, широко используемые в генно-инженерных работах.
Заключительной стадией клонирования генов является выделение и исследование клонированной ДНК, включая секвенирование. Перспективные штаммы бактерий или соматических клеток, содержащих рекомбинантные молекулы ДНК, которые контролируют синтез интересующих белков, имеющих коммерческую ценность, передают в промышленность.
|
|
|
|
|
Дата добавления: 2015-04-25; Просмотров: 944; Нарушение авторских прав?; Мы поможем в написании вашей работы!