
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Статика процесса абсорбции
|
|
|
|
Общие сведения. Физические основы процесса.
VI Массообмен в процессе абсорбции.
Абсорбция – это процесс избирательного поглощения компонентов из газовых или парогазовых смесей жидким поглотителем (абсорбентом).
При физической абсорбции поглощаемый компонент не взаимодействует химически с абсорбентом. Процесс в большинстве случаев обратим. На этом свойстве основано выделение поглощённого компонента из раствора – десорбция. Если поглощаемый компонент образует с абсорбентом химическое соединение, то процесс называют хемосорбцией.
В промышленности процесс абсорбции обычно сочетают с десорбцией, что позволяет многократно использовать абсорбент.
Примерами использования процессов абсорбции в промышленности могут служить:
а) разделение углеводородных газов на нефтеперерабатывающих установках;
б) получение соляной и серной кислот, аммиачной воды;
в) очистка газовых выбросов от вредных примесей;
г) выделение ценных компонентов из газов крекинга или пиролиза метана, из газов коксовых печей и т.д.
Абсорбенты выбирают по растворимости в них поглощаемых компонентов. Растворимость газов в жидких поглотителях зависит:
1) от физических и химических свойств газовой и жидкой фаз;
2) от температуры;
3) от давления газа в смеси.
Равновесие между фазами определяется правилом фаз Гиббсона: число параметров (или ступеней свободы) С процесса равно числу компонентов К минус число фаз Ф плюс 2:
С = К – Ф + 2 (6-1)
Процесс абсорбции осуществляется в двухфазной (газ – жидкость) трёхкомпонентной системе. Согласно правилу фаз - С = К – Ф + 2 = 3 – 2 + 2 = 3. Следовательно, не нарушая равновесия в системе, можно варьировать тремя её параметрами (например, температурой, давлением и составом одной из фаз)
В двухфазных системах газ – жидкость равновесие выражается в виде фазовых диаграмм состав-состав или состав-свойство (например, состав-давление или состав-температура кипения).
Для абсорбционно-десорбционных процессов равновесие между газами и их растворами в жидкости описывается законом Генри, по которому при данной температуре количество газа, растворяющегося в жидкости, прямо пропорционально давлению газа над ней:
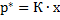 , (6-2) где
, (6-2) где 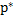 - равновесное порциальное давление растворённого газа; х – содержание растворённого газа в жидкости (в мольных долях или
- равновесное порциальное давление растворённого газа; х – содержание растворённого газа в жидкости (в мольных долях или 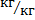 - поглотителя); К - константа Генри, зависящая от свойств растворённого газа и поглотителя, а также от температуры, имеет размерность давления.
- поглотителя); К - константа Генри, зависящая от свойств растворённого газа и поглотителя, а также от температуры, имеет размерность давления.
При практических расчётах по значениям равновесного порциального давления газа 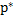 вычисляют равновесное содержание абсорбируемого компонента в газовой смеси по уравнению Рауля – Дальтона
вычисляют равновесное содержание абсорбируемого компонента в газовой смеси по уравнению Рауля – Дальтона 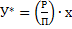 , где Р – давление паров чистого компонента, определяемое по закону Рауля, как
, где Р – давление паров чистого компонента, определяемое по закону Рауля, как 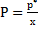 ; П – общее давление газовой смеси.
; П – общее давление газовой смеси.
Следовательно, 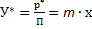 , т.е. уравнение равновесия для процесса абсорбции при низкоконденсированных растворах газов представляет собой уравнение прямой линии
, т.е. уравнение равновесия для процесса абсорбции при низкоконденсированных растворах газов представляет собой уравнение прямой линии 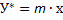 с тангенсом угла наклона, равным
с тангенсом угла наклона, равным 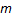 , а отношение постоянных величин
, а отношение постоянных величин  – коэффициент распределения, постоянный для данной системы газ жидкость при
– коэффициент распределения, постоянный для данной системы газ жидкость при 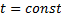 и
и 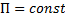 (см. рис. 6-1).
(см. рис. 6-1).
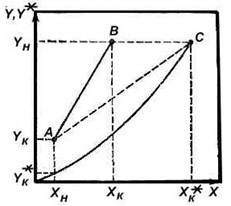
Рис.6-1.Линия равновесия абсорбции (у*=mx):
1 – для разбавленных растворов газа; 2 – для концентрированных растворов
Рис.6.2.Рабочая и равновесная линии абсорбера:
АВ – рабочая линия при расходе поглотителя L; АС – то же при Lмин ; начало координат – С – равновесная линия У*=f(x)
Из закона Генри следует, что растворимость газа в жидкости увеличивается с повышением давления П и понижение температуры. Для понижения температуры охлаждают исходные газовую смесь и поглотитель, отводят теплоту, выделяющуюся в процессе абсорбции с помощью встроенных (внутренних) или наружных теплообменников.
По данным о растворимости поглощаемых компонентов осуществляется выбор поглотителей (абсорбентов) - лучший поглотитель тот, у которого расход для процесса меньший. Кроме того, при выборе абсорбента оценивают такие свойства, как селективность (избирательность) к поглощаемому компоненту, токсичность, пожароопасность, стоимость, доступность и т.д. При оценке физико-химических свойств системы поглощаемый газ – поглотитель учитывают, что лучшим является тот абсорбент, в смеси с которым поглощаемый компонент имеет наименьший коэффициент активности 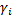 , т.е. те жидкости, которые составляют с поглощаемым компонентом системы с отрицательным отклонением от идеального поведения
, т.е. те жидкости, которые составляют с поглощаемым компонентом системы с отрицательным отклонением от идеального поведения 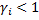 . Абсорбент должен обладать меньшей летучестью во избежание больших потерь.
. Абсорбент должен обладать меньшей летучестью во избежание больших потерь.
|
|
|
|
|
Дата добавления: 2015-03-29; Просмотров: 1213; Нарушение авторских прав?; Мы поможем в написании вашей работы!