
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос 3 . Газовые законы
|
|
|
|
Мокс
М окс
M
Если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа.
Всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав.
В качестве примера рассмотрим состав воды: качественный ее состав- она состоит из кислорода и водорода, количественный состав – 88,89% и 11,11%,соответственно.
Она имеет выше приведенный состав независимо от того, как она получена: синтезом из водорода и кислорода, реакцией нейтрализации или из кристаллогидратов.
Оксид углерода (II) СО содержит - 42,88% (масс) С
57,12% (масс) О
Оксид углерода(IV) СО2 содержит - 27,29% (масс) С
72,71% (масс) О
Однако постоянный и неизменный химический состав наблюдается только для молекул (NH3, SO2), а также кристаллов с молекулярной структурой.
Состав соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Закон постоянства состава не применим к жидким и твердым растворам (Н2О и NаCl – раствор).
Вещества постоянного состава называются дальтонидами (в честь Дальтона), а переменного состава – бертоллидами (в память Бертолле).
Состав дальтонидов выражается формулами с целочисленными стехиометрическими индексами (HCl, CH4, Н2О), а бертоллиды – с дробными стехиометрическими индексами. Оксид ванадия (II) может иметь, в зависимости от условий получения, состав от VO0,9 до VO1,3. Бертоллиды встречаются среди бинарных соединений оксидов, гидридов, сульфидов, нитридов, карбидов, силицидов и других неорганических веществ, имеющих кристаллическую структуру.
К бертоллидам относится оксид железа II, состав его изображен формулой Fе1-хО, х < 1, т.е. в зависимости от условий можно получить оксиды железа состава Fе0,93О или Fе0,89О.
Как вытекает из закона постоянства состава, элементы взаимодействуют между собой в строго определенных количественных соотношениях. В этом случае можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
в) закон кратных отношений
Закон кратных отношений установлен 1803 году Джоном Дальтоном.
На примере оксидов азота – их 5
Масса кислорода на 1г азота
Отношение массы кислорода, приходящейся на 1г азота к 0,5714 (N2O)
N2O (1∙ 16): (2∙ 14) = 0, 5714
N O (1∙ 16): (1∙ 14) = 1,428
N2O3 (3∙ 16): (2∙ 14) = 1,7143
NO2 (2∙ 16): (1∙ 14) = 2,2857
N2O5 (5 16): (2∙ 14) = 2,8571
Или на примере оксидов серы:
Ar(S) = 32 Ar(O) = 16
1) SO2 m(S): m(O) = 32: 32 = 1: 1
2) SO3 m(S): m(O) = 32: 48 = 2: 3
г) закон эквивалентов
Одновременно с з аконом кратных отношений был сформулирован закон эквивалентов.
Эквивалент - это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному катиону водорода или в ОВР одному электрону.
Фактор эквивалентности ƒэкв.(х) или 1/Z число, равное той доле частице Х, которая является эквивалентом вещества в данной реакции.(ƒэкв ≤ 1)
ƒэкв рассчитывают на основании стехиометрических коэффициентов реакции.
Например:
(1) H2S + 2Na OH = Na2S +H2O ƒэкв (H2S) =1/2
В этом случае одному катиону H+ эквивалентна условная частица, равная 1/2 молекулы H2S (участвуют оба иона водорода каждой молекулы).
(2) H2S + Na OH = NaHS +H2O ƒэкв.(H2S) =1
Одному иону H+ эквивалентна реальная частица – молекула H2 S (в молекуле H2S замещается только один катион водорода).
Количество моль - эквивалентов измеряется в молях, как любое количество вещества. Масса 1 моль эквивалента, молярная масса эквивалента, равна произведению фактора эквивалентности на молярную массу вещества
M(ƒэкв (х) х) = ƒэкв (х) ∙ М(х)
Так, молярная масса эквивалента иона алюминия
М(1/3Аl+3) =1/3 ∙ 27 = 9 г/моль
Количествомоль - эквивалентов можно определить по формуле
nэкв = ——
Mэкв
Молярная масса эквивалента и эквивалент элемента не являются постоянной величиной в соединении, а зависят от валентности или степени окисления элемента.
Например:
Мэкв(С) в 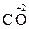 = 12 ∙ 1/2 = 6 г/моль
= 12 ∙ 1/2 = 6 г/моль
Мэкв(С) в  = 12 ∙ 1/4 = 3 г/моль
= 12 ∙ 1/4 = 3 г/моль
Постоянными являются эквиваленты Мэ (Н) = 1,008 г/моль Мэ(О) = 8 г/моль, Мэ (Аl) = 9 г/моль, Мэ (Са) = 20 г/моль.
Если не учитывать конкретную химическую реакцию, то фактор эквивалентности и молярная масса эквивалентов сложных веществ рассчитываются по формулам:
 ;
;
Мэ 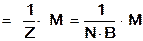 =
=  ,
,
где М – молярная масса вещества
В - валентность функциональной группы
N - число функциональных групп
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла и т.д. (H+, OH-, Kat +n, An-n)
Для определения эквивалентной массы сложного вещества в реакции следует разделить его полную массу (М) на сумму замещенных радикалов (H+, OH-, Kat+n, Ann-)
NaH+ SO4 + NaCl = Na2SO4 + HCl
ƒэ NaHSO4 = 1
ZnOH-NO3 + HNO3 = Zn(NO3)2 + H2O
ƒэ ZnOHNO3 =1
H2SO4 + NaCl = NaHSO4 + HCl
ƒэ HSO4 = 1
NaHCO3 + CaSO4 = CaCO3 ↓ + NaHSO4
ƒэ NaHCO3 = 1/2
Fe(OH)2Cl + 2HCl = FeCl3 +2H2O
ƒэ Fe(OH)2Cl =1/2
H2SO4 + 2KOH = K2SO4 +2H2O
ƒэ H2SO4 =1/2
AlOH- SO4-2 + 3HCl = AlCl3 + H2SO4 + H2O
ƒэ AlOHSO4 = 1/3
Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O
ƒэ Al(OH)3 = 1/3
KAl(SO4 )2 + 2BaCl 2 = KCl + AlCl3 + 2BaSO4↓
ƒэ KAl(SO4)2 = 1/4
1) для кислот: ƒэкв равен единице, деленной на основность кислоты, которая определяется числом ионов водорода
1/Z = ƒэкв (HCl) = 1
1/Z = ƒэкв (H2 SO4) = 1/2
1/Z = ƒэкв (H3 PO4) = 1/3
Молярная масса эквивалента кислоты равна произведению фактора эквивалентности на молярную массу кислоты
Мк
Мэ кислоты = ƒэкв ∙ Мк = —
Nн+
где: Мк - молекулярная (формульная) масса кислоты
Nн+ - число атомов водорода, способных замещаться на металл.
Пример: Мэ (H2 SO4) = 1/2 ∙ 98 = 49 г/моль
Молярная масса эквивалента кислоты может быть рассчитана как сумма молярных масс эквивалентов водорода и кислотного остатка: Мэ (H2 SO4) = Мэ (Н+) + Мэ (SO4 2-) = 1 + 48 = 49 г/моль
2) для оснований ƒэкв равен единице, деленной на кислотность, равную числу гидроксогрупп, вступающих в реакцию
ƒэкв (NaOH) = 1/Z (NaOH) = 1
ƒэкв (Ca(OH)2) = 1/Z (Ca(OH)2) = 1/2
Молярная масса эквивалента основания равна произведению фактора эквивалентности на молярную массу основания
Мосн
Мэ основания = ƒэкв ∙ Мосн = ——
Nон-
Пример Мэ [ Cr(OH)3 ] = 1/3 ∙ 103 = 34,3 г/моль
Молярная масса эквивалента основания может быть рассчитана как сумма молярных масс эквивалентов металла и гидроксогруппы Мэ [ Cr(OH)3 ] = 52/3 + 17 = 34,3 г/моль
3) для солей: ƒэкв соли равен единице, деленной на произведение числа атомов металла в молекуле соли на степень окисления металла.
ƒэкв (Na2SO4) = 1/Z (Na2SO4) =1/2
ƒэкв Al2(SO4)3 = 1/2 ∙ 3
Молярная масса эквивалента соли равна произведению фактора эквивалентности на молярную массу соли
Мэ соли = ƒэкв соли ∙ Мс = 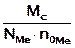

Nме – число атомов металла
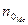 - степень окисления металла
- степень окисления металла
3 4 2
Мэ Al2(SO4)3= ——— = 57 г/моль
2 ∙ 3
Молярная масса эквивалента соли может быть рассчитана как сумма молярных масс металла и кислотного остатка
Мэ Al2(SO4)3 = 27/3 +48 = 57г/моль
4) для оксидов ƒэкв равен единице, деленной на произведение числа атомов кислорода на степень окисления кислорода
ƒэкв (H2O) = 1/Z (H2O) = 1/2
ƒэкв (SO2) = 1/Z (SO2) = 1/4
ƒэкв (Mn2O7) = ——
7∙ 2
Молярная масса эквивалента оксида равна произведению фактора эквивалентности на молярную массу оксида
Мэ оксида = ƒэкв ∙ Мокс = ———
No ∙ noО.
где: Nо - число атомов кислорода
nоО – степень окисления кислорода в оксиде, которая равна всегда - 2.
Мэ оксида = ———
Nо ∙ 2
Например:
Мэ (Mn2O7) = —— = 15,9 г/моль
7 ∙ 2
Молярная масса эквивалента оксида может быть рассчитана как сумма молярных масс эквивалентов элемента и кислорода Мэ (Mn2O7) = 55/7 + 8 = 15,9 г/моль
В ОВР для определения ƒэкв необходимо единицу разделить на число отданных или присоединенных электронов.
Вещества вступают в реакцию в эквивалентных количествах:
2Н2 + О2 = 2Н2О
4экв 4экв 4экв
В 1792 г. немецким физиком Рихтером был сформулирован закон эквивалентов: массы реагирующих друг с другом веществ (m1,m2) пропорциональны молярным массам их эквивалентов (МЭ1,МЭ2)
m1 Mэ1 m1 m2
—— = ——— < = > —— = ——
m2 МЭ2 MЭ1 МЭ2
Из математической записи закона эквивалентов следует, что количество моль - эквивалентов веществ в реакции равны между собой.
n экв1 = nэкв2
Для реакций с участием газов используют молярный объем эквивалента – это объем, занимаемый 1 моль-эквивалентом газа.
Так, МЭ(Н) = 1г/моль, если моль газа 2г/моль занимают V=22,4л, то 1 эквивалент – в два раза меньший объем, равный 11,2 л.
VЭКВ (Н2) = 22,4: 2 = 11,2л.
Аналогично МЭКВ(О)= 1/4М(О2) = 32: 4 = 8г/моль, отсюда Vэ(О2) = 22,4: 4 = 5,6л.
Тогда математическая запись закона через эквивалентный объем:
mв-ва Vгаза mв-ва МЭв-ва
—— = —— <=> —— = ——
MЭв Vэгаза Vгаза VЭг
|
|
|
|
|
Дата добавления: 2015-05-06; Просмотров: 1187; Нарушение авторских прав?; Мы поможем в написании вашей работы!