
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вопрос). Применение Основная масса анилина используется для производства красителей
|
|
|
|
Применение Основная масса анилина используется для производства красителей. При действии на анилин окислителей последовательно образуется вещества различного цвета, например так называемый чёрный анилин.Кроме того, анилин является исходным продуктом для синтеза многих лекарственных веществ, например сульфаниламидных препаратов, анилиноформальдегидных смол и некоторых взрывчатых веществ.
Билет 30. 1. Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:  При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении. Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: с основными и амфотерными оксидами:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении. Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: с основными и амфотерными оксидами: 
 с основаниями:
с основаниями: 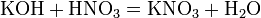 вытесняет слабые кислоты из их солей:
вытесняет слабые кислоты из их солей:  При кипении или под действием света азотная кислота частично разлагается:
При кипении или под действием света азотная кислота частично разлагается: 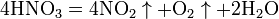 Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3  Разбавленная HNO3
Разбавленная HNO3  с металлами, стоящими в ряду напряжений левее водорода:
с металлами, стоящими в ряду напряжений левее водорода: 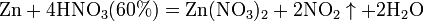


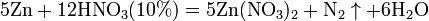
 Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот: увеличение концентрации кислоты
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот: увеличение концентрации кислоты 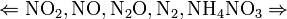 увеличение активности металла. С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа: Fe+4HNO3àFe(NO3)3+NO2+2H2O
увеличение активности металла. С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа: Fe+4HNO3àFe(NO3)3+NO2+2H2O 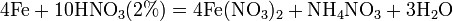 Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2: 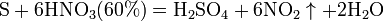

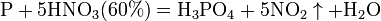
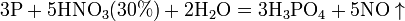
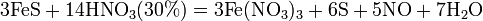 Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила: 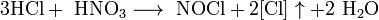
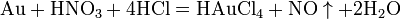
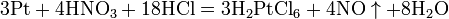 Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой: 4NH3 + 5O2 (Pt) → 4NO + 6H2O 2NO + O2 → 2NO2 4NO2 + O2 + 2H2O → 4HNO3 Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑ Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой: 4NH3 + 5O2 (Pt) → 4NO + 6H2O 2NO + O2 → 2NO2 4NO2 + O2 + 2H2O → 4HNO3 Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: 4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑ Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
2. Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей. Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (d). Атом, "оттягивающий" электронную плотность s-связи в свою сторону, приобретает отрицательный заряд d-. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по s-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд d+, будет называться электронодонором. Смещение электронной плотности по цепи s-связей называется индуктивным эффектом и обозначается I. Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех s -связей обозначается прямыми стрелками. В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность s-связи от атома углерода к себе, проявляют отрицательный индуктивный эффект (-I-эффект). Электродонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I-эффект). +I-эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют -I-эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы. Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. При передаче индуктивного эффекта метальной группы на двойную связь в первую очередь ее влияние испытывает подвижная p-связь. Влияние заместителя на распределение электронной плотности, передаваемое по p-связям, называют мезомерным эффектом (М). Мезомерный эффект также может быть отрицательным и положительным. В структурных формулах его изображают изогнутой стрелкой, начинающейся у центра электронной плотности и завершающейся в том месте, куда смещается электронная плотность. Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
Билет 7. 2. Ароматические гетероциклы представляют собой плоские циклические системы, содержащие вместо одного или нескольких атомов углерода атомы кислорода, серы, азота. Ароматическими их называют вследствие того, что они удовлетворяют всем критериям, присущим любой ароматической системе, а именно:система является циклической;цикл является плоским;имеется сопряжение по всему циклу, то есть возможность беспрепятственной делокализации любого из p-электронов по всей системе, благодаря наличию негибридизованных р-орбиталей;число делокализованных p-электронов, участвующих в сопряжении, отвечает, согласно правилу Хюккеля, проявлению ароматических свойств, а именно, равно 4n+2, где n – любое натуральное число, включая 0.Среди ароматических гетероциклических соединений наиболее широко распространены и, соответственно, представляют наибольший интерес 5- и 6-членные гетероциклы, имеющие в своем составе азот, серу и кислород, а также эти же системы, конденсированные с бензольным кольцом.К пятичленным циклическим системам с одним гетероатомом относятся пиррол, фуран и тиофен: 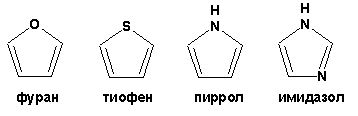 Из пятичленных гетероциклов с двумя гетероатомами наибольший практический интерес представляет имидазол. К конденсированным с бензольным кольцом пятичленным гетероциклам относятся 2,3-бензопиррол (индол, I), 3,4-бензопиррол (изоиндол, II), бензимидазол (III), бензофуран (IV) и 2,3-бензотиофен (V):
Из пятичленных гетероциклов с двумя гетероатомами наибольший практический интерес представляет имидазол. К конденсированным с бензольным кольцом пятичленным гетероциклам относятся 2,3-бензопиррол (индол, I), 3,4-бензопиррол (изоиндол, II), бензимидазол (III), бензофуран (IV) и 2,3-бензотиофен (V):  Наиболее важными из шестичленных гетероциклов являются пиридин, пиримидин, хинолин (бензопиридин) и пурин:
Наиболее важными из шестичленных гетероциклов являются пиридин, пиримидин, хинолин (бензопиридин) и пурин: 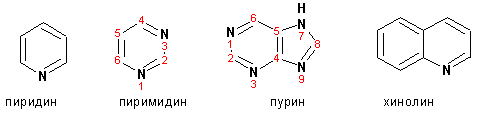
Теория государства и права - это наука, которая изучает государство и право в их историческом развитии. Теория государства и права как наука - это базовая фундаментальная юридическая наука, изучающая общие вопросы происхождения, становления, развития и функционирования государства и права.
Предметом науки теории государства и права являются объективные свойства государства и права, отличающихся от всех других общественных явлений, а также закономерности их возникновения, функционирования и развития как относительно самостоятельных общественных институтов.
Предмет теории государства и права — это общие закономерности возникновения, функционирования и развития государства и права, их сущность, структура, основные элементы, принципы, институты.
Объект изучения теории государства и права - это целостное явление государства и права, изучаемое также, со стороны своего предмета иными науки. Объектом изучения науки теории государства и права выступает государство и право.
Функции теории государства и права как науки - это характерная и прикладная составляющая теории государства и права, отражающая значимость и необходимость науки теории государства и права для общества и исследователей государственно- правовых явлений.
Можно выделить следующие функции теории государства и права:
- Онтологическая, отраженна в научных изысканиях науки теории государства и права в сфере наиболее философских вопросов бытия общества, в частности, что есть государство и право.
- Гносеологическая функция (познавательная), отраженная в деятельности по выявлению сущности и природы теории государства и права, накоплению теоретических знаний по этому вопросу.
- Идеологическая функция, отраженна в том, что выводы и достижения науки теории государства и права влияют на правосознание, правовую культуру индивида, а также на государственную идеологию.
- Эвристическая функция, находит отражение в результатах изыскания науки теории государства и права, в открытии последней новых закономерностей происхождения, становления, развития и функционирования государства и права.
- Образовательная функция, отраженна в том, что наука теории государства и права вырабатывает базу для учебной дисциплины теории государства.
- Методологическая функция, отраженна в том, что наука теории государства и права, являясь основополагающей юридической наукой, вырабатывает систему понятий и категорий, на основе которых строятся иные юридические науки.
Практико-организационная функция выражается в том, что теория государства и права, как всякая наука, должна обслуживать практику. Она должна вырабатывать, и вырабатывает рекомендации, направленные на совершенствование государственно-правового строительства, законодательства, юридической практики.
Суть прогностической функции состоит в том, что теория государства и права должна прогнозировать будущее государственно-правовых явлений. Выявляя закономерности их развития, теория государства и права вполне способна давать прогнозы, как на ближайшее будущее, так и на перспективу в виде научных гипотез (предположений).
Мировоззренческая - вырабатывать правовые ценности, совершенствовать правосознание общества, его правовую культуру, формировать основы правовой пропаганды и правового воспитания.
Праксеологическая (прикладная) - формулировать практические предложения по совершенствованию системы государственного управления и правовой системы.
Прогностическая - выявить тенденции развития государства и права, предсказать и смоделировать варианты их будущего развития.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 617; Нарушение авторских прав?; Мы поможем в написании вашей работы!