
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет №2. Строение атомов химических элементов на примере элементов второго периода и IV-A группы периодической системы химических элементов Д
|
|
|
|
Строение атомов химических элементов на примере элементов второго периода и IV-A группы периодической системы химических элементов Д. И. Менделеева. Закономерности в изменении свойств этих химических элементов и образованных ими простых и сложных веществ (оксидов, гидроксидов) в зависимости от строения их атомов.
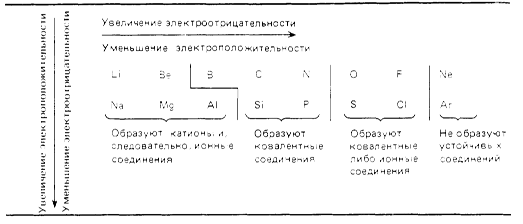
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко выраженные металлические свойства. Элементы, расположенные в средней части коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную ковалентнуто структуру, а элементы из правой части этих периодов существуют в виде простых ковалентных молекул.

Атомные радиусы изменяются следующим образом: уменьшаются при перемещении слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль группы. При перемещении слева направо по периоду возрастает электроотрицательность, энергия ионизации и сродство к электрону, которые достигают максимума у галогенов. У благородных же газов электроотрицательность равна 0. Изменение сродства к электрону элементов при перемещении сверху вниз вдоль группы не столь характерны, но при этом уменьшается электроотрицательность элементов.
В элементах второго периода заполняются 2s, а затем 2р-орбитали.
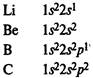
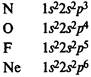
Главная подгруппа IV группы периодической системы химических элементов Д. М. Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb. Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s2p2). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна +4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии ионизации и радиуса их атомов. С увеличением атомного номера свойства элементов закономерно изменяются. Так, углерод и кремний — типичные неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной оболочки атома p-элементы IV группы имеют четные степени окисления: +4, +2, – 4. Формула простейших водородных соединений — ЭН4, причем связи Э—Н ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с образованием направленных под тетраэдрическими углами sp3 -орбиталей.
Ослабление признаков неметаллического элемента означает, что в подгруппе (С—Si—Ge—Sn—Pb) высшая положительная степень окисления +4 становится все менее характерной, а более типичной становится степень окисления +2. Так, если для углерода наиболее устойчивы соединения, в которых он имеет степень окисления +4, то для свинца устойчивы соединения, в которых он проявляет степень окисления +2.
А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 7879; Нарушение авторских прав?; Мы поможем в написании вашей работы!